有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛。请回答:
Ⅰ.若X是短周期最活泼的金属元素。
(1)写出Y的单质的结构式 。
(2)写出单质Z与元素Y的最高价氧化物对应的水化物(稀溶液,过量)反应的离子方程式 。
Ⅱ.若X的简单离子半径是第三周期元素简单离子半径最小的。
(3)在定向爆破中,常利用氧化铁和单质X反应放出的热量来切割钢筋。该反应的化学方程式为 。
(4)已知X的阳极氧化是一种常用的金属表面处理技术,它能使X的表面形成致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中模拟该处理过程,装置如图所示,该阳极的电极反应式为 。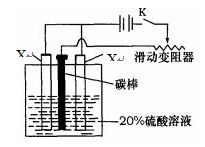
Ⅲ.含Z的化合物A(化学式为K2ZO4)极易溶于水,但静置一段时间后转化为红褐色沉淀,同时产生O2。
(5)化合物A溶于水后的变化 (用离子方程式表示)。查阅资料发现,加入下列物质中的 可提高A在水中的稳定性。
| A.Na2CO3 | B.KSCN | C.NH4NO3 | D.KOH |
氮族元素的最外层电子数为,随着核电荷数的递增,原子半径逐渐,得电子的能力逐渐,非金属性逐渐,其气态氢化物的稳定性逐渐。
填写下列表格:(填:增大、减小、不变、正向移动、逆向移动或没影响)
| 可逆反应 |
N2(g) + 3H2(g) 2NH3(g) (正反应 2NH3(g) (正反应 为放热反应) 为放热反应) |
|||
| 改变的条件 |
v(N2) |
v(NH3) |
化学反应速率 |
对化学平衡的影响 |
| 减小N2的浓度 |
减小 |
逆向移动 |
||
| 增加NH3的浓度 |
增大 |
增大 |
||
| 增加体系的压强 |
增大 |
增大 |
||
| 升高体系温度 |
增大 |
增大 |
||
| 使用催化剂 |
增大 |
没影响 |
按要求书写下列方程式。
① NaHCO3溶液的电离方程式:。
② H2S溶液的电离方程式:。
③ NH4NO3溶液的水解离子方程式:。
④ Na2CO3溶液的水解离子方程式:。
物质的量浓度相同、体积相同的HCl、H2SO4、CH3COOH等三种溶液,
(1)三种溶液中氢离子浓度最大的是。
(2)分别用0.1mol/L的NaOH溶液中和,其中消耗NaOH溶液最多是。
已知某反应2A B + C在某一温度时,达到平衡。
B + C在某一温度时,达到平衡。
(1)若升高温度时,平衡向正反应方向移动,则正反应是热反应;
(2)若减少压强时,平衡向正反应方向移动,则A呈态;
(3)若该反应达到平衡时,加入一定量的B物质,平衡将会向逆反应方向移动,则B的转化率,C的转化率。