下列离子方程式正确的是
| A.向次氯酸钙溶液中通入少量CO2:2ClO-+H2O+CO2=CO32—+2HClO |
| B.向明矾溶液中加入足量Ba(OH)2溶液:Al3++2SO42—+4OH-+2Ba2+=2BaSO4↓+[Al(OH)4]- |
| C.向FeCl3溶液中加入足量单质锌:Zn+2Fe3+=Zn2++2Fe2+ |
| D.向NaHSO4中滴加Ba(OH)2溶液至中性:H++SO42—+OH-+Ba2+=BaSO4↓+H2O |
可逆反应N2+3H2===2NH3(正反应是放热反应)达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法都正确的是()
| A.升高温度、降低压强、增加氮气 | B.降低温度、增大压强、加入催化剂 |
| C.升高温度、增大压强、增加氮气 | D.降低温度、增大压强、分离出部分氨 |
在甲、乙、丙三个体积相等的密闭容器里进行CO2(g)+H2(g)===H2O(g)+CO(g)反应,温度相同,起始浓度不同。甲、乙、丙中各物质的量分别为:n(CO2)=n(H2)="a" mol;n(CO2)="a" mol,n(H2)="2a" mol ; n(CO2) =n(H2)=n(H2O)=" a" mol,达到平衡时,CO的物质的量由大到小的顺序是()
| A.乙>甲>丙 | B.甲>丙>乙 | C.乙>丙>甲 | D.甲>乙>丙 |
在一密闭容器中,反应aA(g)===bB(g)达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的60%,则()
| A.平衡向正反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数减少了 | D.化学计算数关系:a >b |
下列几个达到平衡的反应中,增大压强或升高温度,平衡都向右移动的是()
| A.H2(g)+ I2(g)===2HI(g)(正反应是放热反应) |
| B.NH4HCO3===NH3+H2O+CO2(正反应是吸热反应) |
| C.2NO2===N2O4(正反应是放热反应) |
| D.3O2===2O3 (正反应是吸热反应) |
已知某可逆反应:mA(g) + nB(g)="==" pC(g)在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与反应物B在混合气体的体积分数(B%)的关系曲线。由曲线分析下列判断正确的是()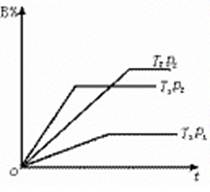
| A.T1<T2 P1 >P2m + n >p 正反应为吸热反应 |
| B.T1 >T2 P2 >P1 m +n< p 正反应为吸热反应 |
| C.T2 >T1 P2 >P1m + n< p 正反应为吸热反应 |
| D.T1 >T2 P2 >P1 m +n< p 正反应为放热反应 |