Ⅰ.A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的最高价氧化物的水化物呈两性。试回答:
(1)D元素在周期表中的位置为 ;
(2)由A、D、E三种元素形成的盐的水溶液呈酸性,用离子方程式解释其原因 ;
(3)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池负极的电极反应式: 。
Ⅱ.将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1mol·L-1Na2CO3溶液中,向此反应后的溶液中滴加0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅲ.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
| n(M):n(H2O) |
M转化率 |
H2O转化率 |
| 1:1 |
0.5 |
0.5 |
| 1:2 |
0.67 |
0.33 |
| 1:3 |
0.75 |
0.25 |
①该反应的平衡常数为_____。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正____V逆(填“>”、“<”或“=”)
②结合表中数据判断下列说法中正确的是 。
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
如图是实验室制乙酸乙酯的装置。
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是将_____________ 。
然后轻轻地振荡试管,使之混合均匀。
(2)书写制乙酸乙酯的化学方程式 。
(3)装置中通蒸气的导管要在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸,造成倒吸的原因是__________________________。
(4)浓硫酸的作用:①________;②________。
(5)饱和Na2CO3溶液的作用是_____________ 。
A是实验室中常见的有机物,它易溶于水,具有特殊香味,并能进行如下图所示的多种反应。已知C中所含碳原子数是A中的2倍。
(1)A的分子式为________,官能团 。
(2)写出下列反应的化学方程式。
反应①:___________________________;
反应②:___________________________;
反应④:___________________________。
(3)比较反应①与钠和水反应的现象的相同点和不同点。
相同点:___________________________________;
不同点:___________________________________。
Ⅰ、有下列五种烃:①  ②
②  ③乙烷 ④戊烷 ⑤
③乙烷 ④戊烷 ⑤ ,其中互为同分异构体的是 (填序号),②与⑤之间的关系为 ,② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是 (填序号)。
,其中互为同分异构体的是 (填序号),②与⑤之间的关系为 ,② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是 (填序号)。
Ⅱ、某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
(1)写出A的电子式 ,E的结构简式为 ;
(2)写出下列反应化学方程式,并注明③⑤反应类型
② __________________________;
③ _____________ ,反应类型______ __;
⑤ __________________ ,反应类型_____ ___;
(3)除去B中混有的少量杂质A,所用的试剂为 。
碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1)Ca原子结构示意图 。
(2)Ca与最活跃的非金属元素A形成化合物D,D的沸点比A与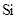 形成的化合物E的沸点 (填高或低),用电子式表示D的形成过程 。
形成的化合物E的沸点 (填高或低),用电子式表示D的形成过程 。
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n。则M位于元素周期表中的位置是: 。
(4)取1.6g钙线试样,与水充分反应,生成224ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3 g.