下列指定反应的离子方程式正确的是
| A.用白醋除铁锈:Fe2O3·xH2O + 6H+= (3+x)H2O + 2Fe3+ |
| B.用强碱溶液吸收工业制取硝酸尾气: NO + NO2 + 2OH-= 2NO3- + H2O |
| C.将少量SO2气体通入氨水中:SO2 + NH3·H2O=NH4++ HSO3- |
| D.向稀硫酸中加入少量Ba(OH)2溶液:2H++ SO42-+ Ba2++ 2OH-= BaSO4↓ + 2H2O |
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是
| A.氯气 | B.二氧化碳 | C.碘化钾 | D.醋酸钠 |
对于达到平衡的可逆反应:X+Y W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是
W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是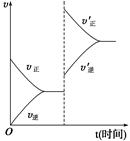
| A.Z、W为气体,X、Y中之一为气体 |
| B.Z、W中之一为气体,X、Y为非气体 |
| C.X、Y为气体,Z、W为非气体 |
| D.X、Y为气体,Z、W中至少有一种为气体 |
一定温度下,可逆反应A2(s)+3B2(g) 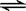 2AB3(g)达到平衡的标志是()
2AB3(g)达到平衡的标志是()
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时消耗3mol B2 |
| C.混合气体总的物质的量不再改变 |
| D.密闭容器内的物质的质量不再改变 |
在容积固定的密闭容器中存在如下反应: A(g)+3B(g) 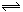 2C(g)该反应正反应为放热反应。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误的是()
2C(g)该反应正反应为放热反应。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误的是()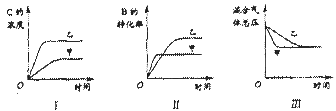
| A.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| B.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
| C.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| D.图I研究的是压强对反应的影响,且乙的压强较高 |
X、Y、Z、M、N代表五种金属,有以下化学反应:①水溶液中:X+Y2+=X2++Y②Z+2H2O(冷)=Z(OH)2+H2↑ ③M、N为电极与N盐溶液组成原电池 ,发生的电极反应为:M-2e-=M2+④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,这五种金属的活动性由弱到强的顺序是:
,发生的电极反应为:M-2e-=M2+④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,这五种金属的活动性由弱到强的顺序是:
| A.M<N<Y<X<Z | B.N<M<X<Y<Z | C.N<M<Y<X<Z | D.X<Z<N<M<Y |