300℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g) +Y(g) 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.当v逆(X)=2v正(Z),可以说明反应达平衡
B.反应前2 min的平均速率v(Z)=4.0×10‒3 mol·L‒1·min‒1
C.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
D.该反应在350℃时的平衡常数小于1.44
最近,科学家冶炼出纯度高达99.999 %的铝,你估计它具有性质是()
| A.熔点比铁铝合金小 |
| B.在冷、浓HNO3中可以钝化 |
| C.在空气中放置容易生锈,进而被腐蚀 |
| D.当它与铁的粉碎粒度相同时,与4mol/L盐酸反应速率比纯铁大 |
下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况 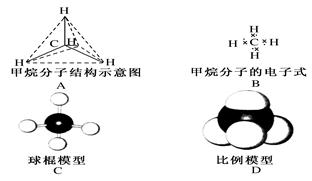
下列叙述正确的是
| A.电解精炼金属时,含杂质的粗金属做阳极,与电源正极相连 |
| B.电解池中金属导线中电子由电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极 |
| C.在电解池中,电解质溶液中的阴离子向阴极移动,阳离子向阳极移动 |
| D.在电解精炼金属过程中,电解质溶液的成分不发生任何变化 |
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后下列关系式中正确的是
| A.c (Na+)=c(CH3COO-)+c(CH3COOH) | B.c(CH3COOH) =c(CH3COO-) |
| C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) | D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
在25℃时,将两个铜电极插入到一定的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到amol的气体的同时,溶液中析出了bmol的结晶水合物Na2SO4·10H2O,若保持温度不变,则所剩溶液中溶质的质量分数是
| A.71b/18a | B.71b/36a | C.71b/(161b+18a) | D.71b/(161b+9a) |