下列溶液中微粒的物质的量浓度关系正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液:c(H+)= c(OH-)= c(NH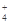 )=c(Cl-) )=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| D.常温下,pH=2的CH3COOH与pH=12的NaOH等体积混合:c (CH3COO-)+ c(H+)>c(Na+)+c(OH-) |
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x的值是
| A.2 | B.3 | C.4 | D.5 |
郑老师做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成有少量KSCN和FeCl2溶液,溶液显红色。判断下列说法中正确的是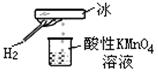
| A.该条件下生成的水分子化学性质比较活泼 |
| B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性 |
| C.该条件下H2燃烧生成了具有氧化性的物质 |
| D.该条件下H2燃烧的产物中可能含有一定量的H2O2 |
A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A.原子序数:A>B>C>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
氯化碘(ICl)跟水发生反应:ICl+H2O=HIO+HCl,这个过程可以称为ICl的水解。预计PCl3水解的产物是
| A.PH3和HClO | B.HCl和H3PO4 | C.HCl和H3PO3 | D.HCl和HPO3 |
下列性质的比较中,正确的是
| A.熔点:Li<Na<K<Rb | |
| B.沸点:NH3<PH3<AsH3<SbH3 |
C.热稳定性:SiH4>PH3>H2O>HF |
| D.酸性:H2SO3>H3PO4>HF>H2CO3>H2S>HClO |