能正确表示下列反应的离子方程式是
| A.将铜屑加入氯化铁溶液中 2Fe3++Cu=2Fe2++ Cu2+ |
| B.氢氧化镁与稀硫酸反应 H++ OH— = H2O |
| C.向小苏打溶液中加入醋酸溶液 HCO3—+ H+ = CO2↑+ H2O |
| D.将铁粉加入稀硫酸中 2Fe + 6 H+ =2Fe3+ + 3H2↑ |
对于X+Y(g) Z的平衡,若增大压强,Y的转化率增大,则X和Z可能的状态是()
Z的平衡,若增大压强,Y的转化率增大,则X和Z可能的状态是()
| A.X为气态,Z为固态 | B.X为固态,Z为气态 |
| C.X为气态,Z为气态 | D.无法确定 |
有平衡体系CO(g)+2H2(g)====CH3OH(g) ΔH<0,为增加甲醇的产量,应采取的正确措施是()
| A.高温、高压 | B.适宜的温度、高压、催化剂 |
| C.低温、低压 | D.高温、高压、催化剂 |
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2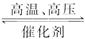 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是()
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)
 N2(g)+CO2(g) ΔH="-373.2" kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是()
N2(g)+CO2(g) ΔH="-373.2" kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是()
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是()
2Z(g),此反应达到平衡的标志是()
| A.容器内压强不随时间变化 |
| B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1∶2∶2 |
| D.单位时间消耗0.1 mol X的同时生成0.2 mol Z |