(15分)为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验: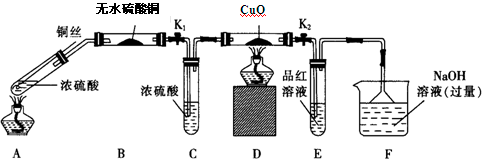
(1)F装置的烧杯中发生反应的离子方程式是 ;B装置中的现象是 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+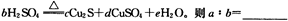
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用O.36 mol·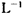 的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
(已知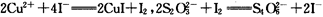 )
)
(14分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
电解时,粗铜应与电源的 ▲ _极相连,阴极上的电极反应式为▲。
电解过程中,硫酸铜的浓度会▲(选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:▲ 。残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
| 序号 |
反应 |
化学平衡常数 |
| 1 |
Au + 6HNO3(浓)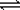 Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl- ="" AuCl4- |
>>1 |
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因▲。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+的浓度为▲ mol·L-1,Fe2+的浓度为▲mol·L-1
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。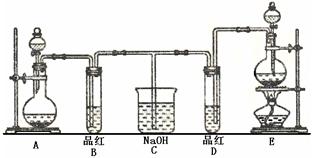
(1)实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中 ▲装置(填装置序号)制Cl2。在制Cl2的反应中浓盐酸所表现出的性质是 ▲。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个
试管加热,两个试管中的现象分别为B:▲,D:▲。
(3)装置C的作用是 ▲。
(4)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析: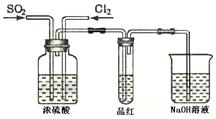
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是: ▲。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ▲,并写出其相应的离子方程式: ▲。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: ▲。
某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。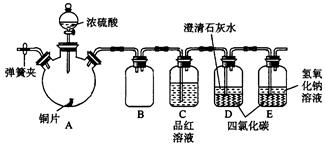
实验选用铜片、98.3%的H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜片一端没入浓H2SO4中,另一端露置在液面上方。
回答下列问题。
(1)Cu与浓H2SO4的反应的化学方程式为____________________。
(2)D、E两容器中CCl4的作用是____________________。
(3)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,A容器下有白色沉淀生成,你认为该沉淀物是_________________,分析可能的原因是____________________。
(4)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是__________________,设计实验验证你的猜想__________________。
(5)实验结束后,为了减少环境污染,排除各装置中的SO2,可采取的操作是___________。
某校研究性学习小组拟利用分光光度法对空气中二氧化硫含量(mg/m3)进行测定。分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析。其工作原理可以简单的用公式表示为A=kc,其中A为吸光度,k为一定条件下的常数,c为溶液浓度。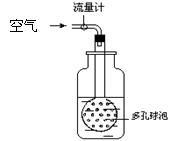

实验步骤如下:
⑴ 采样:
① 如果你是该小组成员,你对采样的地点和时间有何建议:。
② 用右图装置采样,通过50L空气后,将吸收液移入100ml容量瓶,用少量吸
收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用。用多孔球泡而不
用导管的原因是。
⑵ 吸光度与SO2含量标准曲线的绘制:在6支25ml比色管中,用每毫升含25μg
二氧化硫的标准液配置下表标准SO2含量系列。
二氧化硫标准系列
| 管 号 |
0 |
1 |
2 |
3 |
4 |
5 |
| 标准液(ml) |
0 |
0.20 |
0.40 |
0.60 |
0.80 |
1.00 |
| 吸收液(ml) |
10.00 |
9.80 |
9.60 |
9.40 |
9.20 |
9.00 |
| 二氧化硫含量(μg) |
0 |
5.00 |
10.00 |
15.00 |
20.00 |
25.00 |
用10mL比色皿,以水为参比,测定各管吸光度,实验结果如下。
| 管 号 |
0 |
1 |
2 |
3 |
4 |
5 |
| 吸光度 |
0 |
0.20 |
0.40 |
0.60 |
0.80 |
1.00 |
请在右图所示的坐标系中绘制标准曲线:
⑶ 准确量取容量瓶中溶液10mL加入比色皿,测得其吸光度值
为0.10,则空气中二氧化硫含量为mg/m3。我国环境空气
质量标准中对每次空气质量测定中SO2的最高浓度限值(mg/m3):
一级标准:0.15;二级标准:0.50;三级标准:0.70。
则该市空气为级标准。
⑷ 甲、乙两组同学测定结果相差较大,乙组同学测定空气中SO2
含量偏小,试分析乙组同学出现误差的可能原因:(两个所用
药品和装置均无问题)。
凯氏定氮法测定奶粉中蛋白质含量的步骤如下: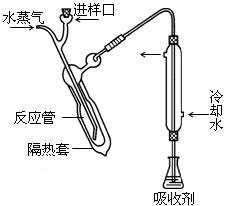
① 样品处理:准确称取奶粉试样1.000 g置于烧瓶中,加入足量不含氮元素的试剂A,一定条件下充分反应,产物用水溶解并冷却后全部转移至100 mL容量瓶中定容。
② 碱化蒸馏:量取容量瓶中溶液10.00 mL转移至右图所示的反应管中,再加入足量NaOH溶液,塞好进样口橡皮塞。通入高温水蒸气。用吸收剂吸收产生的气体。
③ 滴定:向吸收气体后的溶液中滴加2滴指示剂,用0.01 mol/LHCl标准溶液滴定至终点。
已知:
吸收剂中发生的反应为:NH3+4H3BO3=NH4HB4O7+5H2O;
滴定时发生的反应为:NH4HB4O7+HCl+5H2O=NH4Cl+4H3BO3。
根据以上知识回答下列问题:
⑴ 样品处理的目的是;通入高温水蒸汽的作用除加热外,还有。
⑵ 冷凝管的作用是冷凝、导气、。
⑶ 若蛋白质中氮元素的平均含量为16.0%,滴定终点时消耗盐酸标准液15.50 mL,则该奶粉中蛋白质的含量为%。
⑷ 凯氏定氮法测定奶粉中蛋白质含量灵敏度高,操作简单,缺点是。