如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是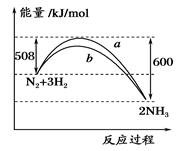
| A.加入催化剂,不能改变该化学反应的反应热 |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.该反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g),ΔH=-92 kJ/mol |
| D.在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ |
有关NaHCO3与Na2CO3的说法正确的是
A Na2CO3俗称纯碱,所以Na2CO3属于碱
B 将石灰水加入到NaHCO3溶液中不产生沉淀
C NaHCO3遇到盐酸放出CO2的反应要比Na2CO3剧烈
D 等质量的NaHCO3和Na2CO3与足量的盐酸反应,在相同条件下Na2CO3产生的CO2的体积大
如图所示的实验中,投入铝片后: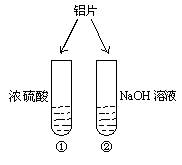
A ①和②中都不产生气泡B ①和②中都产生气泡,且都是H2
C①中产生大量气泡,②中不产生气泡D ①中无明显现象,②中产生大量气泡
下列离子方程式书写正确的是
A二氧化碳通入过量的澄清石灰水中:OH-+CO2=HCO3-
B金属钠投入到水中:2Na+2H2O=2Na++2OH-+H2↑
C次氯酸钙溶液中通入过量的SO2:ClO-+H2O+SO2 = HSO3-+HClO
D向硫酸铜溶液中加入过量氢氧化钡溶液: Ba2++SO42-=BaSO4↓
分别除去下列括号中的杂质,所选试剂或操作不正确的是:
A SiO2(CaO):HCl B MgO(Al2O3):NaOH
C CO2(SO2):Ca(OH)2D NaCl(NH4Cl):加热
下面是几个不同价态的氮的化合物的相互转化关系(未配平),你认为一定不能实现的是
A NO2+H2O→HNO3+NO B NO+HNO3→N2O3+H2O
C N2O4+H2O→HNO3+HNO2D NH3+NO→HNO2+H2O