下列离子方程式正确的是
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+ 4Fe3++2H2O 4Fe3++2H2O |
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO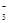 +2OH-===CaCO3↓+CO +2OH-===CaCO3↓+CO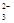 +2H2O +2H2O |
| C.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑ |
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO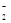 +4NH +4NH +2H2O +2H2O |
有关化学实验的下列操作中,一般情况下不能相互接触的是()
| A.过滤操作中,玻璃棒与三层滤纸 |
| B.过滤操作中,漏斗径与烧杯内壁 |
| C.分液操作中,分液漏斗径与烧杯内壁 |
| D.用胶头滴管向试管滴液体时,滴管尖端与试管内壁 |
选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是()
| A.不溶于水,且必须易与碘发生化学反应 | B.不溶于水,且比水更易溶解碘 |
| C.不溶于水,且必须比水密度大 | D.不溶于水,且必须比水密度小 |
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是( )
| A.①④②⑤③ | B.④①②⑤③ | C.②④①⑤③ | D.⑤②④①③ |
一定量某营养液中溶质的配方分别如下:
配方一:0.3mol KCl,0.2mol K2SO4,0.1 molZn SO4
配方二:0.1 mol KCl,0.3 mol K2SO4,0.1 molZnCl2
对于两种营养液的成分,下列说法中正确的是( )
| A.只有n (K+)相同 | B.只有n (Cl-)相同 |
| C.完全相同 | D.各离子的物质的量完全不同 |
分离下列混合物,按溶解、过滤、蒸发顺序进行的是()
| A.氧化铜、木炭 | B.碳酸钙、氯化钠 |
| C.硝酸钾、氯化钠 | D.乙醇、水 |