现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3-+ Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。
造成下列现象与什么物质相关:
赤潮,水俣病,地方性甲状腺肿大,贫血。
大米的主要成分是:(填化学式);苷氨酸的结构简式是:;
写出一个检验葡萄糖的化学反应方程式:
钢含碳量为:;玻璃、陶瓷、水泥一定含 _____元素;
油脂在体内水解后的产物是: ____
请把下列食物和其所含的最主要的营养物质之间连线:
馒头、米饭油脂
鱼、瘦肉、豆腐维生素
各种蔬菜、水果蛋白质
植物油、肥猪肉糖类
(1)某有机物含有C、H、O三种元素。经燃烧分析实验测定其碳的质量分数是64.86%。下图是该有机物的质谱图。则该有机物的分子式为
(2)完全燃烧某有机物4.3 g生成4.48 L(标准状况)CO2和2.7 g H2O。则该有机物的实验式为
醇在催化作用下氧化成醛的反应是绿色化学的研究内容之一。某科研小组研究了钯催化剂在氧气气氛中对一系列醇氧化成醛反应的催化效果,反应条件为:K2CO3、363K、甲苯(溶剂)。实验结果如下: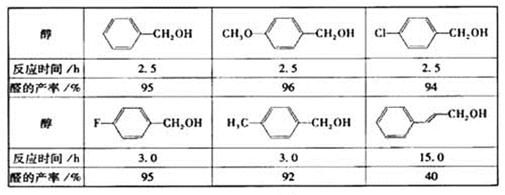
分析表中数据,得到钯催化剂催化效果的主要结论是
(写出2条)。