X、Y、Z、W为原子序数依次增大的短周期元素.X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;X、Z处于同一主族,W的最外层电子数等于其电子层数.
(1)Y在元素周期表的位置是 .Z在氧气中燃烧的产物所含化学键类型有 .
(2)W元素的原子结构示意图是 .Z最高价氧化物的水化物与W的最高价氧化物的水化物,碱性较强的是 (填化学式).
(3)甲和Y的最高价氧化物的水化物反应生成乙.在0.1 mol·L-1乙溶液中,所含离子浓度由大到小的顺序是 .
(4)25℃时,W的最高价氧化物的水化物KSP=1.0×10-34,使含0.1 mol·L-1 W离子的溶液开始产生沉淀的pH为 .
(5)已知298K时:2Fe(s)+O2(g)="==" 2FeO(s) △H=-544.0kJ·mol-1
4W(s)+3 O2(g)===2W2O3(s) △H=-3351.4 kJ·mol-1
则W单质和FeO反应的热化学方程式为 .
元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
(1).三氟化溴(BrF3)常用于核燃料生产和后处理,遇水立即发生如下反应:3BrF3 +5H2O → HBrO3 + Br2 + 9HF+ O2 。该反应中氧化剂与还原剂的物质的量之比为 ,每生成2.24 LO2(标准状况)转移电子数为 。
(2).在食盐中添加少量碘酸钾可预防缺碘。为了检验食盐中的碘酸钾,可加入醋酸和淀粉-碘化钾溶液。看到的现象是 ,相应的离子方程式是 。
氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)  Cl2(aq)---------------①
Cl2(aq)---------------①
Cl2(aq)+ H2O  HClO + H+ +Cl------②
HClO + H+ +Cl------②
HClO  H+ + ClO- ---------------③
H+ + ClO- ---------------③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如下图所示。
(3).写出上述体系中属于电离平衡的平衡常数表达式:Ki = ,由图可知该常数值为 。
(4).在该体系中c(HClO) + c(ClO-) c(H+)-c(OH-)(填“大于”“小于”或“等于”)。
(5).用氯处理饮用水时,夏季的杀菌效果比冬季 (填“好”或“差”),请用勒夏特列原理解释 。
铁是人类生产和生活中必不可少的重要金属。
(1).自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___________。
计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%……是指各同位素的____________________。
(2).铁原子中有______种能量不同的电子,铁原子次外层的电子云有_____种不同的伸展方向。
(3).与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为________________________________。
(4).要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于_________极,电解质溶液是____________________。
(5).高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
___Fe(NO3)3 + ___NaOH + ___Cl2 →___Na2FeO4 + ___NaNO3 + ___NaCl + ___H2O
高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是_____________________。
(6).0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积________________L。
二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g) CH3OCH3(g)+H2O(g) 。完成下列填空:
CH3OCH3(g)+H2O(g) 。完成下列填空:
(1).有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式 ;
写出甲醇分子中官能团的电子式 。
(2).碳与同主族的短周期元素相比,非金属性较强的是 (填元素符号)。写出一个能证明你的结论的化学方程式 。
(3).在温度和体积不变的情况下,能说明反应已达到平衡状态的是 (选填编号)。
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
(4).一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
| 容器 编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| I |
387 |
0.40 |
0.16 |
0.16 |
| Ⅱ |
387 |
0.80 |
a |
|
| Ⅲ |
207 |
0.40 |
0.18 |
0.18 |
①若要提高CH3OH的平衡转化率,可以采取的措施是 (选填编号)。
a.及时移走产物 b.升高温度c.充入CH3OHd.降低温度
②I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为 (用含t的式子表示)。II号容器中a = mol。
(5).若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向 (填“正”“逆”)反应方向进行。
以硫铁矿(主要成分为FeS2)为原料制取硫酸,其烧渣可用来炼铁。
(1)煅烧硫铁矿时发生反应:FeS2+O2→Fe2O3+SO2(未配平)。当产生448 L(标准状况)SO2时,消耗O2的物质的量为________。
(2)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。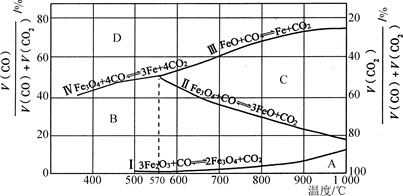
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:ⅰ.3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
ⅱ.Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
ⅲ.FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH3=c kJ·mol-1
①反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH=________kJ·mol-1(用含a、b、c的代数式表示)。
②800 ℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为____________。
③据图分析,下列说法正确的是________(填字母)。
a.温度低于570 ℃时,Fe2O3还原焙烧的产物中不含FeO
b.温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c.Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
(3)FeS2是Li/FeS2电池(示意图如图)的正极活性物质。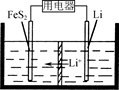
①FeSO4、Na2S2O3、S及H2O在200 ℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式______________。
②Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li===Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li===2Li++FeS22-,则第2步正极的电极反应式为____________________。
Mn(OH)2常用作油漆催干剂。向MnSO4溶液加入NaOH溶液,待沉淀完全后,过滤,洗涤,烘干即可制得Mn(OH)2。
(1)已知:常温下Mn(OH)2的Ksp=1.0×10-15。如果要使溶液中Mn2+沉淀完全,则应该保持溶液中c(OH—)≥ mol·L—1[当c(Mn2+)≤10-5mol/L时,即可认为溶液中Mn2+沉淀完全]。
(2)Mn(OH)2还可以通过MnO2与二氧化硫气体充分接触,再与石灰乳反应制得,写出该反应的总的化学方程式 。
(3)一种含Mn2+的结晶水合物组成为AxMnyBz·mH2O(A表示一种阳离子,B表示一种阴离子)。现称取39.10 g晶体配成100 mL溶液X,取20 mL溶液X,向其中加入足量的氢氧化钠溶液,加热,得到896 mL气体(标准状况);另取20 mL溶液X,向其中加入盐酸,无沉淀产生,再加入BaCl2溶液,产生白色沉淀,过滤,洗涤,烘干,得到固体9.32 g。
①A、B的离子符号分别为 、 。
②通过计算确定该结晶水合物的化学式(写出计算过程)。