(1)写出下列各物质的名称,填入括号内。
CH4 → CH3Cl → CH3OH → HCHO → HCOOH → HCOOC2H5
(甲烷)→( )→(甲醇)→( )→( )→( )
(2)某有机物的结构简式如图:
①当其和________________反应时,可转化为 。
。
②当其和________________反应时,可转化为  。
。
③当和________________反应时,可转化为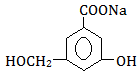 。
。
④欲将 转化为
转化为 ,则应加入__________________。
,则应加入__________________。
有A、B、C、D、E五种烃,具有下列性质:①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO2均为4.48L(标准状况),A和D燃烧所得的CO2都是前三者的3倍;②在适宜条件下,A、B、C都能跟氢气发生加成反应,其中A可以转化为D,B可以转化为C,C可以转化为E;③B和C都能使溴水或酸性KMnO4溶液褪色,而A、D、 E无此性质;④用铁屑作催化剂时,A可与溴发生取代反应。判断A、B、C、D、E各是什么物质,写出结构简式:
A___________ B___________ C___________ D____________ E____________
下图是某药物中间体的结构示意图: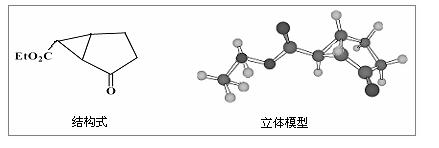
试回答下列问题:
(1)观察上面的结构式与立体模型,通过对比指出结构式中的“Et”表示(填
结构简式);该药物中间体分子的化学式为。
(2)请你根据结构示意图,推测该化合物所能发生的反应类
型。
(3)解决有机分子结构问题的最强有力手段是核磁共振氢谱(PMR)。有机化合物分子中
有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积与氢原
子数目成正比。
现有一种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上图所示,试写出该化合物的结构简式
已知 可简写为
可简写为 。降冰片烯的分子结构可表示为
。降冰片烯的分子结构可表示为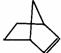 :
:
(1)降冰片烯属于__________。
A. 环烃 B. 不饱和烃 C. 烷烃 D. 芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯不具有的性质__________。
A.能溶于水B.发生氧化反应 C.加成反应D.常温常压下为气体
根据图示填空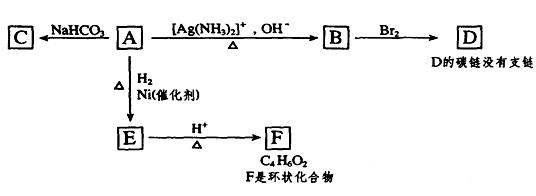
(1)化合物A中含氧官能团的名称是 。
(2)1mol A与2 mol H2反应生成1 mol E,其反应方程式是
___________________________________________________。
(3)B在酸性条件下与Br2反应得到D,D的结构简式是 。写出D与NaOH溶液反应的化学方程式_________________________________________。
(4)F的结构简式是 。
有A、B、C、D、E五种烃,具有下列性质:①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO2均为4.48L(标准状况),A和D燃烧所得的CO2都是前三者的3倍;②在适宜条件下,A、B、C都能跟氢气发生加成反应,其中A可以转化为D,B可以转化为C,C可以转化为E;③B和C都能使溴水或酸性KMnO4溶液褪色,而A、D、 E无此性质;④用铁屑作催化剂时,A可与溴发生取代反应。判断A、B、C、D、E各是什么物质,写出结构简式:
A___________ B___________ C___________ D____________ E____________