Na2FeO4是一种新型水处理剂,可以通过下列反应制取:
湿法制备的主要反应方程为:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4 +2Na2SO4
下列有关该反应的说法错误的是
| A.两反应中Na2FeO4均为氧化产物 |
| B.Na2FeO4有强氧化性,可消毒杀菌,其还原产物能吸附水中杂质 |
| C.干法中每生成1mol Na2FeO4转移3mol电子 |
| D.碱性条件下,NaClO氧化性大于Na2FeO4 |
根据下列实验或实验操作和现象,所得结论正确的是
| 实验或实验操作 |
现象 |
实验结论 |
|
| A |
用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 |
出现白色沉淀 |
H2CO3的酸性比H2SiO3的酸性强 |
| B |
向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 |
有白色沉淀生成 |
原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
| C |
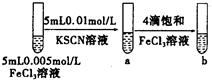 |
试管b比试管a中溶液的红色深 |
增大反应物浓度,平衡向正反应方向移动 |
| D |
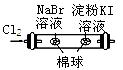 |
左边棉球变为橙色,右边棉球变为蓝色 |
氧化性:Cl2>Br2>I2 |
用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法不正确的是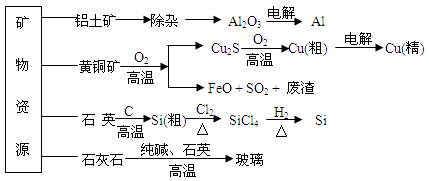
| A.制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO |
| B.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
| C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 |
| D.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |
下列有关说法正确的是
| A.常温下,0.1 mol·L-1 Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| B.常温下,0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) |
C.常温下,将0.1 mol·L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中 的值增大到原来的10倍 的值增大到原来的10倍 |
| D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是
| A.四种元素的原子半径:rZ>rX>rY>rw |
| B.X、Y、Z、W形成的单质最多有6种 |
| C.四种元素中,Z的最高价氧化物对应水化物酸性最强 |
| D.四种元素均可与氢元素形成18电子分子 |
下列说法正确的是
| A.分子式为C10H12O2的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种 |
B.对苯二甲酸(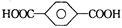 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维(  ) ) |
| C.分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 |
D. 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |