下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。
试回答下列问题: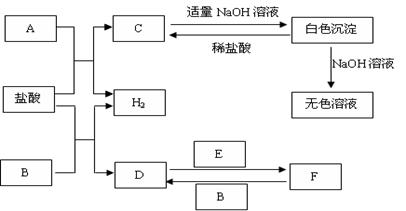
(1)A在周期表中的位置是 ;
(2)检验F中金属阳离子的常用方法是 。
(3)白色沉淀与NaOH溶液反应的离子方程式是 。
(4)反应F→D的化学方程式是 。
 Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知: ①Z的原子序数为29,其余的均为短周期主族元素;
①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布msnmpn;
②Y原子价电子(外围电子)排布msnmpn; ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子总数分别为2和4。
④Q、X原子p轨道的电子总数分别为2和4。 请回答
请回答 下列问题:
下列问题: (1)Z2+ 的核外电子排布式是。
(1)Z2+ 的核外电子排布式是。 (2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的形成配位键。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的形成配位键。 (3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。 a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙 c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙 (4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答)
(4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答) (5)Q的一种氢化物分子中质子总数为14,其中分子中的σ键与π键的键数之比为。
(5)Q的一种氢化物分子中质子总数为14,其中分子中的σ键与π键的键数之比为。

 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,其余电子均成对。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,其余电子均成对。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题: (1)X元素在元素周期表中的位置为__________,该元素的符号是__________;
(1)X元素在元素周期表中的位置为__________,该元素的符号是__________; (2)Y元素原子的价层电子的轨道表示式(即价电子排布图)为_____ ,该元素的名称是__________。
(2)Y元素原子的价层电子的轨道表示式(即价电子排布图)为_____ ,该元素的名称是__________。 (3)X
(3)X 与Z可形成化合物XZ3,该化合物分子为含________键的________分子(填“极性” 或“非极性”)。
与Z可形成化合物XZ3,该化合物分子为含________键的________分子(填“极性” 或“非极性”)。 (4)
(4) 比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明沸点高低的理由。(用化学式表示)
比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明沸点高低的理由。(用化学式表示)
稳定性由强到弱的顺序为____________。沸点由高到低的顺序为______________,
理由是____________。
(8 分)
分)
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压 下,Y单质是淡黄色固体,常在火山口附近沉积 下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)X原子共有种不同运动状态的电子。Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。
在H―Y、H―Z两种共价键中,键的极性比较:H―Y H―Z,键长H―Y H―Z。(填>或<)
(3)W的基态原子外围电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。
已知A是一 种烃类,其相对分子量为56,1molA与氧气充分燃烧后生成4molCO2。
种烃类,其相对分子量为56,1molA与氧气充分燃烧后生成4molCO2。
从化合物A出发有以下转化关系:
根据以上信息,回答以下问题:
(1)化合物A的分子式为 ,结构简式为。
,结构简式为。
(2)反应②的化学方程式为:;
属于(反应类型)。
(3)反应③的化学方程式为:;
属于(反应类型)。
(4)化合物B一定条件下可以与氢气发生加成反应,1molB最多可以消耗molH2 ,请写出该反应化学方程式:。
下图是维生素A的分子结构如下图: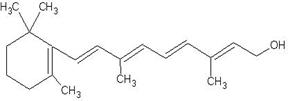
(1)维生素A中的含氧官能团是,
维生素A的分子式是,
(2)1mol维生素A最多能与mol溴反应。
(3)试指出维生素A 可能发生的化学反应、(任写两种类型即可)。
可能发生的化学反应、(任写两种类型即可)。