绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物、实现零排放。下列几种生产乙苯(C6H5-C2H5)的方法中,原子经济性最好的是
A.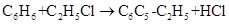 |
B. |
C.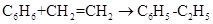 |
D.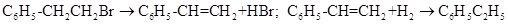 |
下列微粒中只具有还原性的是()
| A.Cl- | B.Cl | C.H+ | D.H2O |
当周围空间不慎有大量氯气溢出时,处在该环境中的人可以用浸有一定浓度某种物质的水溶液的毛巾捂住鼻子,以防中毒,最适宜采用的物质是( )
| A.NaOH | B.KI | C.NH3?H2O | D.Na2CO3 |
为了在实验室制得不含氯化氢的干燥的氯气,正确的净化顺序是()
| A.第一步通过浓硫酸,第二步通过无水氯化钙 |
| B.第一步通过碱石灰,第二步通过浓硫酸 |
| C.第一步通过饱和食盐水, 第二步通过无水氯化钙 |
| D.第一步通过水,第二步通过氧化钙 |
如图所示,接通直流电源,电解饱和食盐水,一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是()
| A.Cl2 | B.O2 | C.H2 | D.HCl |
19世纪末,人类开始揭开原子内部结构的秘密,最先发现电子的科学家是 ( )
| A.法国化学家拉瓦锡 | B.英国物理学家汤姆生 |
| C.意大利物理学家阿伏加德罗 | D.英国化学家道尔顿 |