在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、 富勒烯、含铬物质等。
(1)Fe3+在基态时,价电子排布式为__________________。
(2)KNO3中NO3-的空间构型为________,写出与NO3-互为等电子体的另一种阴离子的化学式:
__________。
(3)6氨基青霉烷酸的结构如图所示。结构中S原子的杂化方式是________;组成中C, N, O三种元素的第一电离能由大到小的顺序是__________________,。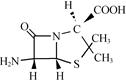
(4)富勒烯(C60)的结构如图所示,该物质能与氯气反应形成C60Cl10分子,1 mol C60Cl10分子中含有碳碳单键的数目为________。
(5)已知配合物CrCl3·6H2O中心原子Cr3+配位数为6,向含0.1 mol CrCl3·6H2O的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全后共消耗 AgNO3溶液50 mL,则该配离子的化学式为________________。
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
| 元素代号 |
相关信息 |
| X |
它的一种核素的原子核内没有中子 |
| Y |
能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z |
基态原子的最外层电子排布式为nsnnpn+1 |
| W |
与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T |
主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色 |
请推出具体元素,用具体元素回答下列问题:
(1)根据元素周期律可以设计出多种形式的周期表,下列是扇形元素周期表: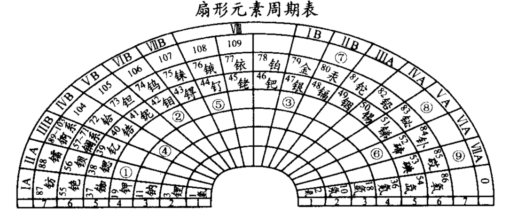
T元素在扇形元素周期表中的位置是(填表中带圆圈的数字);上表中⑨号位置的元素基态原子未成对电子数为;2012年6月25日,俄罗斯杜布纳核联合研究所再次成功合成117号元素,它将被列入元素周期表,“117”元素在扇形元素周期表中的位置是(填表中带圆圈的数字)。
(2)质量数为2的X基态原子的电子排布式为,在这五种元素中电负性最大的是。
(3)由上述五种元素中的某些元素形成的离子,该离子中每个原子最外层均有8个电子且与Z3-具有相同质子数和电子数,则这种离子的结构式为。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
X3W+(aq)+WX(aq)=2X2W(1)ΔH="-57.3" KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子厅程式表示):。
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: 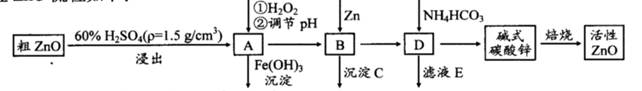
已知此溶液中Fe2+、Fe3+、Cu2+、Zn2+形成氢氧化物的pH如下表:
| 离子 |
开始沉淀的pH |
完全沉淀的pH |
| Fe2+ |
6.4 |
8.4 |
| Fe3+ |
2.4 |
3.1 |
| Cu2+ |
5.2 |
6.7 |
| Zn2+ |
6.8 |
9 |
(1)实验室中用98%H2SO4来配制100 mL60%稀硫酸所需使用的玻璃仪器有:烧杯、量筒、、、。
(2)写出在A中加H2O2的离子方程式:。
(3)向A中可以加入(写化学式)调节溶液pH范围在之间;沉淀C为。
(4)碱式碳酸锌[Zn3(OH)4CO3·H2O]焙烧制备活性ZnO的化学方程式为。
苯酚是重要的工业原料之一,工业上采用苯酚合成有机物D的路线如下:
请回答下列问题:
(1)有机物A分子官能团是(写名称)。B的结构简式是,其核磁共振氢谱图中有种峰。
(2)C→D的反应类型是,D与足量NaOH溶液共热时反应的化学方程式:
(3)X是B的同分异构体,X分子中含有苯环,其中苯环上一氯代物只有两种,且能发生银镜反应,则X的所有结构简式有 、、、。
、、、。
(4)有关化合物C的说法正确的是(填字母)
| A.能发生加成反应 |
| B.一定条件下,可以在NaOH醇溶液中发生消去反应 |
| C.1molC与足量NaOH溶液共热,最多消耗2molNaOH |
| D.属于酯类物质 |
X、Y、Z、W是短周期中常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X元素形成的一种同素异形体是天然晶体中硬度最大的单质 |
| Y |
常温常压下,Y单质是淡黄色固体,用于制造黑火药 |
| Z |
Z的基态原子核外有3个能级上有电子,且有3个单电子 |
| W |
W元素形成的双原子分子,常温下为黄绿色气体,一种常见工业原料 |
(1)W元素位于元素周期表中第周期族,与Y同主族且位于第四周期元素的基态原子核外电子排布式为。
(2)XY2分子中含有的σ键和π键个数比为,在相同条件下XY2与XO2相比,熔点较高的是(填化学式)。结合相关理论解释Z所在族的元素第一电离能大于同周期后一族元素的原因:。
(3)Y、W元素形成的化合物Y2W2和过量氢化物ZH3在无水条件下反应生成Y4Z4、单质Y8和一种可以作为化肥的物质,请写出相应化学方程式:。
(4)已知:①lmolY(s)转化为气态Y(g) \吸收能量280 kJ;
②2XO(g)+O2(g)= 2XO2(g) ΔH=-566.0KJ/mol;
③Y(s)+O2(g)=YO2(g) ΔH=-299.0KJ/mol;一定条件下,可以利用X的氧化物XO和Y的氧化物YO2生成Y(g)单质和X的氧化物而达到消除污染目的。请写出该反应的热化学方程式:。
有机物A(C10H20O2)具有兰花香味,可用做香皂、洗发香波的芳香赋予剂。已知:
①B分子中没有支链。②D能与碳酸氧钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯原子取代,其一氯代物只有一种。④F可以使溴的四氯化碳溶液褪色。
(1)D可以发生的反应有(选填序号)。
①取代反应②消去反应③加聚反应④氧化反应
(2)C分子所含的官能团的结构简式是____,F分子中所含的官能团的名称是____。
(3)任意写出一种与D、E具有相同分子式且属于乙酸酯类的物质结构简式:____
(4)B→C的化学方程式是_,C发生银镜反应的离子方程式为。
(5)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2一甲基—1—丙醇和甲酸在一定条件下制取E。该反应的化学方程式是:____。