下列生产或实验事实引出的相应结论不正确的是
| 选项 |
事实 |
结论 |
| A |
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 |
当其他条件不变时,升高反应温度,化学反应速率加快 |
| B |
工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 |
增大气液接触面积,使SO3的吸收速率增大 |
| C |
在容积可变的密闭容器中发生反应:2NH3(g) 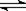 N2H4(l)+H2(g),把容积的体积缩小一半 N2H4(l)+H2(g),把容积的体积缩小一半 |
正反应速率加快,逆反应速率减慢 |
| D |
A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 |
当其他条件不变时,催化剂可以改变化学反应速率 |
PCl5(气)  PCl3(气) +Cl2(气) △H>0 当反应达到平衡时,下列措施:①降温②恒容通入惰性气体③增加Cl2的浓度④加压⑤加催化剂⑥恒压通入惰性气体,能提高PCl5质量分数的是
PCl3(气) +Cl2(气) △H>0 当反应达到平衡时,下列措施:①降温②恒容通入惰性气体③增加Cl2的浓度④加压⑤加催化剂⑥恒压通入惰性气体,能提高PCl5质量分数的是
| A.①②④ | B.①③④ | C.②③⑥ | D.③⑤⑥ |
下列电离方程式书写正确的是()
A.Ca(OH)2 Ca2++ 2OH- Ca2++ 2OH- |
B.H2SO3 2H++ SO32- 2H++ SO32- |
C.NaHS  Na++ HS- Na++ HS- |
D.HCO3— H++ CO32- H++ CO32- |
已知汽车尾气无害化处理反应为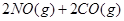

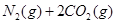 下列说法不正确的是
下列说法不正确的是
| A.反应达到平衡后,N0的反应速率保持恒定 |
| B.使用高效催化剂可有效提高正反应速率 |
| C.升高温度可使该反应的逆反应速率降低 |
| D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
已知反应mA(g)+nB(g)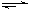 y C(g),如图表示在不同条件下反应物B的体积分数φ(B)随时间变化的关系,据此判断
y C(g),如图表示在不同条件下反应物B的体积分数φ(B)随时间变化的关系,据此判断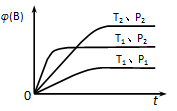
A.m+m<y ,△ H<0
B.m+m>y ,△ H>0
C.m+m<y ,△ H>0
D.m+m>y ,△ H<0
盖斯定律在生产和科学研究中有很重要的作用,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知7.2 g碳在12.8g的氧气中燃烧,至反应物耗尽,放出x kJ热量。已知单质碳的燃烧热为y 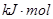
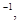 则1 mol C与
则1 mol C与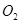 反应生成CO的反应热
反应生成CO的反应热 H为
H为
A.-(2.5x -0.5 y)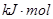 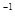 |
B.-(5x - 0.5y) 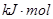 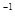 |
C.-(10x - y)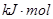 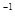 |
D.- y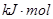 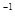 |