在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)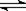 Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
| 温度/℃ |
25 |
80 |
230 |
| 平衡常数 |
5×104 |
2 |
1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4的反应为放热反应
B.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正>v逆
C.25 ℃时反应Ni(CO)4(g) 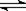 Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
对于相同物质的量的SO2和SO3,下列说法中正确的是()
| A.硫元素的质量比为5∶4 | B.分子数之比为1∶1 |
| C.原子总数之比为4∶3 | D.质量之比为1∶1 |
氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:
CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是()
| A.既不是氧化剂也不是还原剂 | B.是氧化剂 |
| C.是还原剂 | D.既是氧化剂又是还原剂 |
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是()
| A.氢氧化钠与盐酸,;氢氧化钠与碳酸 |
| B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 |
| D.石灰石与硝酸反应;石灰石与盐酸 |
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁(Fe2(SO4)3)、硫酸锌(ZnSO4)和硫酸钾(K2SO4)三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是()C
| A.3∶2∶2 | B.1∶2∶3 | C.1∶3∶3 | D.3∶1∶1 |
下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是()
| A.150 mL 1 mol·L-1的NaCl溶液 | B.75 mL 2 mol·L-1 NH4Cl溶液 |
| C.150 mL 2 mol·L-1的KCl溶液 | D.75 mL 1 mol·L-1的FeCl3溶液 |