相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:
2SO2(g)+O2(g)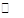 2SO3(g);
2SO3(g);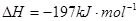 。实验测得起始、平衡时的有关数据如下表:下列叙述正确的是
。实验测得起始、平衡时的有关数据如下表:下列叙述正确的是
| 容器 |
起始各物质的物质的量/mol |
达到平衡时体系能量的变化 |
|||
| SO2 |
O2 |
SO3 |
Ar |
||
| 甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
| 乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
| 丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量:Q3 |
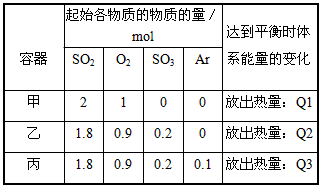
A.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
B.Q1=Q2=Q3="197" kJ
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大
下列离子方程式书写正确的是
A FeCl2溶液中通入Cl2: Fe2++Cl2→Fe3++2Cl-
B澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-→CaCO3↓+H2O
C FeS固体放人稀硝酸溶液中:FeS+2H+→Fe2++H2S↑
D NH4HCO3溶液与过量NaOH溶液反应: NH4++OH-→NH3↑+H2O
下列反应的离子方程式错误的是
| A.向碳酸氢钙溶液中加人过量氢氧化钠 Ca2++2HCO3-+2OH-→CaCO3↓+2H2O+CO32- |
| B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢按溶液混合 Ba2++2OH-+NH++HCO3-→BaCO3↓+NH3·H2O+H2O |
| C.氢氧化铝与足量盐酸反应 Al(OH)3+3H+→Al3++3H2O |
| D.过量CO2通入氢氧化钠溶液中 CO2+2OH-→CO32-+H2O |
下列电离方程式书写正确的是:()
| A.NaHCO3→Na++H++CO32- | B.HF  H++I- H++I- |
C.H2S 2H++S2- 2H++S2- |
D.NaHSO4→Na++H++SO42- |
能说明醋酸是弱电解质的依据是 ()
| A.醋酸能与碳酸钠反应,并有二氧化碳气体生成 |
| B.醋酸溶液能使紫色石蕊试液变红 |
| C.用醋酸溶液做导电性实验时,灯泡较暗 |
| D.在H+物质的量浓度相等的醋酸和盐酸中,前者的物质的量浓度大得多 |
在同体积、同物质的量浓度的H2SO4、HCl、HNO3、CH3COOH溶液中,分别加入足量的Zn,下列说法中正确的是()
| A.硫酸中放出氢气量最多 | B.醋酸中放出氢气量最多 |
| C.盐酸中放出的氢气量最多 | D.盐酸和硝酸中放出的氢气相等 |