某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
| |
50 mL盐酸 |
50 mL盐酸 |
50 mL盐酸 |
| m(混合物) |
9.2 g |
15.7 g |
27.6 g |
| V(CO2)(标况) |
2.24 L |
3.36 L |
3.36 L |
A、盐酸的物质的量浓度为3.0 mol・L-1
B、通过表中数据能计算出混合物中NaHCO3的质量分数
C、加入混合物9.2 g时盐酸未反应完
D、15.7 g混合物恰好与盐酸完全反应
鉴别甲苯、己烯、苯酚溶液、丙烯酸溶液、乙醇,可选用的试剂是
| A.KMnO4溶液、FeCl3溶液 | B.溴水、KMnO4溶液 |
| C.NaOH溶液、FeCl3溶液 | D.溴水、Na2CO3溶液 |
化合物A的结构简式为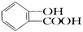 ,已知在一定温度和相同浓度的稀溶液中,下列物质的电离程度有如下顺序:R-COOH>H2CO3>H2S>
,已知在一定温度和相同浓度的稀溶液中,下列物质的电离程度有如下顺序:R-COOH>H2CO3>H2S> >HCO3->HS-,试问A跟下列哪些物质的溶液反应可得化学式为C7H5O3Na的盐
>HCO3->HS-,试问A跟下列哪些物质的溶液反应可得化学式为C7H5O3Na的盐
①NaOH ②Na2S ③NaHCO3 ④NaHS ⑤Na2CO3
| A.③和④ | B.①和② | C.①②③⑤ | D.只有① |
下列推论正确的是
| A.S(g)+O2(g)===SO2(g) ΔH1;S(s)+O2===SO2(g) ΔH2,则ΔH1>ΔH2 |
| B.C(石墨,s)===C(金刚石,s) ΔH=+1.9kJ·mol-1,则金刚石比石墨稳定 |
| C.OH-(aq)+H+(aq)= H2O(l) ΔH=-57.4kJ·mol-1,则:含20gNaOH的稀溶液与过量稀醋酸完全反应,放出的热量为28.7kJ |
| D.2C(s)+O2(g)==="2CO(g)" ΔH=-221kJ·mol-1,则碳的燃烧热大于110.5kJ·mol-1 |
由下列6种基团中的2个不同基团两两组合,形成的物质能与NaOH反应的有
①—OH ②—CH3 ③—COOH ④ ⑤—CHO ⑥—H
⑤—CHO ⑥—H
| A.4种 | B.5种 | C.6种 | D.7种 |
漂白粉的有效成分是
| A.次氯酸钙 | B.氯化钙 |
| C.次氯酸 | D.次氯酸钙与氯化钙 |