以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是
| A.X、Y两端都必须用铁作电极 |
| B.不可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
如图所示,U形管中装入含有紫色石蕊的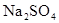 溶液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是:()
溶液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是:()
| A.蓝、紫、红 |
| B.红、蓝、紫 |
| C.红、紫、蓝 |
| D.蓝、红、紫 |
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、 B、D、E金属性由强到弱的顺序为()
A、D﹥A﹥B﹥E B、D﹥E﹥A﹥B
C、A﹥B﹥D﹥E D、A﹥B﹥E﹥D
分别放置下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是()
理论上不能设计为原电池的化学反应是()
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H<0 |
| B.HNO3(1)+NaOH(1)=NaNO3(1)+H2O(1);△H<0 |
| C.2H2(g)+O2(g)=2H2O(1);△H<0 |
| D.2FeCl3(1)+Fe(s)=3FeCl2(1);△H<0 |
要在铁制品上镀上一定厚度的锌层,以下设计方案正确的是()
| A.锌作阳极,铁制品作阴极,溶液含有锌离子 |
| B.铂作阴极,铁制品作阳极,溶液含有锌离子 |
| C.铁作阳极,铁制品作阴极,溶液含有亚铁离子 |
| D.锌用阴极,铁制品作阳极,溶液含有锌离子 |