下列各组中的性质比较,不正确的是
| A.稳定性:NH3<PH3<SiH4 | B.酸性:HClO4>H2SO4>H3PO4 |
| C.碱性:KOH>NaOH>Mg(OH)2 | D.还原性:F-<Cl-<Br- |
在由5种基团-CH3、-OH、-CHO、-C6H5、-COOH两两组合(包含相同基团组合)所形成的物质中,能与NaOH反应的有机物有()
| A.4种 | B.5种 | C.6种 | D.7种 |
北京东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如右下图所示(图中球与球之间的连线代表化学键,如单键、双键等),下列有关该产品的说法正确的是( ) 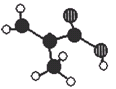
A.该产品的名称是甲基丙酸
B.该产品与甲酸互为同系物
C.四个黑球一定在同一个平面上
D.一定条件下,可以与乙二醇发生酯化反应,也可与氯化氢发生加成反应且产物只有一种
某有机物A 是农药生产中的一种中间体,其结构简式如下。下列叙述中正确的是()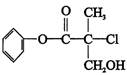
| A.有机物A 属于芳香烃 |
| B.有机物A 可以与Br2的CCl4溶液发生加成反应 |
| C.有机物A 与浓硫酸混合加热,可以发生消去反应 |
| D.1 mo1A 与足量的NaOH 溶液反应,最多可以消耗3mol NaOH |
某烃的衍生物A,分子式为C6H12O2。实验表明A跟氢氧化钠溶液共热生成B和C,B跟盐酸反应生成有机物D,C在铜催化和加热条件下氧化为E,其中D、E都不能发生银镜反应。由此判断A的可能结构有()
A.6种 B.4种 C.3种 D.2种
某饱和一元醇37克跟足金属钠充分反应,收集到5.6升标准状况下的氢气,此醇是()
| A.C4H9OH | B.C3H7OH | C.C2H5OH | D.CH3OH |