用NA表示阿伏加德罗常数的值,下列有关说法不正确的是
| A.标准状况下,22.4L N2与CO混合气体的质量为28g |
| B.常温常压下,金属与酸反应生成2g H2,转移电子数为2 NA |
| C.含0.2 NA个阴离子的Na2O2和水反应时,转移0.2 mol电子 |
| D.1L含NA个NH3·H2O的氨水,其浓度为1mol·L-1 |
运用电离常数判断可以发生的反应是
| 酸 |
电离常数(25oC) |
| 碳酸 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 |
Ki=2.4×10-9 |
A.HBrO+Na2CO3→NaBrO+NaHCO3
B.2HBrO+Na2CO3→2NaBrO+H2O+CO2↑
C.HBrO+NaHCO3→NaBrO+H2O+CO2↑
D.NaBrO+CO2+H2O→NaHCO3+HBrO
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
| 阳离子 |
NH4+、 Na+、 Mg2+ |
| 阴离子 |
OH-、 NO3-、 SO42- |
若取等质量的甲、乙、丙配制成相同体积的溶液,发现溶质的物质的量浓度c(甲)>c(乙)>c(丙),则乙物质
A.可能是NaOH B.可能是NH4NO3
C.不可能有SO42-D.一定不是(NH4)2SO4
六种短周期元素(a、b、c、d、e、f)的原子序数依次增大。其中a与e同主族,b与f同主族,e与f同周期;常温下a、e的单质状态不同;d的核电荷数是b的最外层电子数的2倍;单质f是一种重要的半导体材料。由此可推知
| A.a、c两种元素只能组成化学式为ca3的化合物 |
| B.b、c、d分别与a形成的化合物,沸点由高到低依次为:d>c>b |
| C.原子半径由大到小的顺序是 e>f>b>c>a |
| D.元素的非金属性由强到弱的顺序是 d>c>f>b |
药物贝诺酯可由乙酰水杨酸和对-乙酰氨基酚在一定条件下反应制得:
有关上述反应物和产物的叙述不正确的是
| A.上述三种有机物中共有四种含氧官能团 |
| B.贝诺酯分子中有9种不同化学环境的氢原子 |
| C.贝诺酯与足量NaOH(aq)共热,最多消耗NaOH 4mol |
| D.可用FeCl3(aq) 区别乙酰水杨酸和对-乙酰氨基酚 |
把200mL NH4HCO3和Na2CO3 的混合溶液分成两等份,取一份加入含amol NaOH的溶液恰好反应完全;取另一份加入含bmol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为
| A.(l0b - 5a))mol/L | B.(2b-a)mol/L |
C.( )mol/L )mol/L |
D.(5b-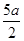 )mol/L )mol/L |