向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
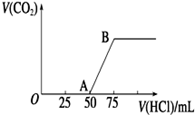
| A.OA段所发生反应的离子方程式:H++OH-==H2O;CO32- +H+ ==HCO3- |
| B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1 |
| C.产生的CO2体积(标准状况下)为0.056 L |
| D.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
下列说法正确的是()
A.若HA、HB均为弱酸,酸性HA>HB,则相同条件下,溶液的PH大小为NaA>NaB
B.相同条件下,将PH=11的NaOH溶液和氨水分别稀释为PH=9的溶液,则加水的体积前者大
C. PH=3的醋酸与PH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
D. 0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2[c(HA—)+c(A2—)+c(H2A)]
在amL浓度为c mol·L-1的AgNO3溶液中加入一定体积的pH=1的盐酸时,恰好使溶液中Ag+完 全沉淀,此时得到pH=2的溶液100 mL(设反应前后溶液体积变化忽略不计),则c的值是
全沉淀,此时得到pH=2的溶液100 mL(设反应前后溶液体积变化忽略不计),则c的值是
| A.0.0020 | B.0.011 | C.0.11 | D.0.22 |
室温时,PH=10的氨水和碳酸钠溶液中,水电离产生的C( H+)前者与后者之比
| A.1:1 | B.10-10:10-4 | C.10-4: 10-10 | D.10-10:10-7 |
下列各组离子在指定环境中一定能大量共存的是
| A.在碳酸氢钠溶液中: K+、Al3+、SO42-、Cl- |
B.存在较多Fe3+的溶液中:Na+、SCN- 、CO32-、K+ 、CO32-、K+ |
| C.常温下由水电离出的C(H+)水·C(OH-)水= 10-24 溶液中:NH4+、Cl-、CO32-、F- |
| D.在能使pH试纸变深蓝色的溶液中:Na+、S2-、CO32-、NO3- |
下列溶液中有关微粒的物质的量浓度的比较正确的是
| A.常温下两种溶液①0.1mol/L CH3COOH溶液②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液 c(H+):①<② |
| B.常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中: c(Na+)= c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-) |
| C.相同条件下,pH=9的①CH3COONa溶液、②NH3·H2O溶液、③NaOH溶液中由水电离出的 c(OH-):①>②>③ |
D.已知酸性HF>CH3COOH,物 质的量浓度相等的NaF与CH3COOK溶液中: 质的量浓度相等的NaF与CH3COOK溶液中: |
[c(Na+)—c(F-)] >[c(K+)—c(CH3COO-)]