某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是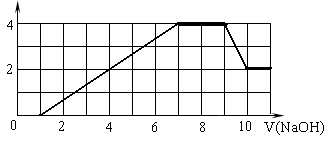
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42— 和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1 |
| D.反应最后形成的溶液中含有的溶质为Na2SO4 |
天然气水合物化学式为 ,外形晶莹剔透酷似冰块却能燃烧,俗称可燃冰。我国科技人员已勘探到海洋中储存有大量可燃冰。下列说法不正确的是
,外形晶莹剔透酷似冰块却能燃烧,俗称可燃冰。我国科技人员已勘探到海洋中储存有大量可燃冰。下列说法不正确的是
| A.可燃冰属于不可再生资源 |
| B.可燃冰的开采需要有计划的进行 |
| C.可燃冰中含碳元素、氢元素和氧元素 |
| D.可燃冰在氧气中充分燃烧只生成二氧化碳 |
下列四个实验方案的设计中,方案1合理、方案2不合理的是
| 选项 |
A |
B |
C |
D |
| 实验 目的 |
除去氢氧化钠中少量的碳酸钠 |
清洗铁制品 表面的铁锈 |
鉴别稀盐酸和氯化钠溶液 |
检验一氧化碳中是否 混有二氧化碳气体 |
| 方案1 |
加水溶解 |
加适量稀盐酸 |
加锌粒 |
点燃 |
| 方案2 |
加稀硫酸 |
用水洗涤 |
加石蕊溶液 |
通入澄清石灰水 |
金属加工后的切削液中含有2%~5%的亚硝酸钠(NaNO2),是一种环境污染物。利用 NH4Cl溶液处理切削液,可使NaNO2转化为无毒物质。该反应分两步进行:①NaNO2 + NH4Cl == NaCl + NH4NO2;②NH4NO2 == N2↑+ 2H2O。下列叙述不正确的是
| A.NaNO2由钠、氮、氧三种元素组成 |
| B.反应①为复分解反应,反应②为分解反应 |
| C.反应中,NaNO2中氮元素的化合价由+3最终变为零 |
| D.利用 NH4Cl 处理NaNO2最终转化为NaCl、NH4NO2、N2和H2O |
欲在实验室配置100 g 16%的氯化钠溶液进行选种,下列做法正确的是
| A.计算:需要16 g氯化钠,100 g水 |
| B.称量:用托盘天平称量所需的氯化钠 |
| C.量取:用50 mL量筒量取所需的水 |
| D.溶解:将称得的氯化钠倒入量筒溶解 |
下列“家庭小实验”不能达到预期目的的是
| A.用柠檬酸、果汁、白糖、水、小苏打等制汽水 |
| B.向洗净的碎鸡蛋壳中加入食盐水制二氧化碳 |
| C.用酒精浸泡捣烂的某些植物的花瓣制酸碱指示剂 |
| D.用塑料瓶、小卵石、石英砂、活性炭、膨松棉等制作简易净水器 |