17.向盛有KI溶液的试管中加入少许CCl4后滴加氯水,振荡,静置,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,静置,CCl4层的颜色会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层南紫色变成无色时所发生反应的化学方程式(如果系数是1,不用写):
(2)整个过程中的还原剂有 。
(3)把KI溶液换成KBr溶液,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20~50 mg/kg。制取加碘盐(含KIO3的食盐)
1000 kg,若用KI与Cl2反应制KIO3,则至少需要消耗Cl2 L(标准状况,保留2位小数)。
按要求完成下列填空:
(1)已知在标准状况下的四种气体①6.72LCH4;②3.01×1023个HCl分子;③13.6克H2S;④0.2molNH3 用相应的序号填写下列空白:
体积最大的是 ;质量最小的是 ;含氢原子数最多的是 。
(2)等物质的量的氧气与臭氧质量之比为 , 分子个数之比为__________,氧原子个数之比为_____________。
(3)某金属氯化物MCl3 26.7 g,含有0.600mol Cl-。则金属M的摩尔质量为__________。
(4)现有10克由2H和16O组成的水分子,其中含质子数为___________mol, 中子数为___________mol 。
实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g) 2C(g);△H =QkJ/mol
2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
| 实验 序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
8 0 0 ℃ |
n2 |
0.60 |
0. 50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= 实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是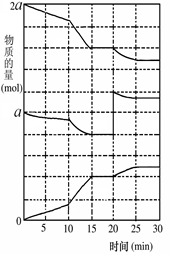
a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的 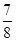 。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的
。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的 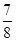 。
。
①a、b、c必须满足的关系是 (一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是
已知2A(g)+B(g) 2C(g) ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g) ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
(1)比较a b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”“=”或“<”)。
| T/K |
T1 |
T2 |
T3 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后, 吸收热量为c kJ,C的浓度 (填“>”“=”或“<”)ω mol/L,a、b、c之间满足何种关系 (用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是
A.4 mol A和2 mol BB.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B D.6 mol A和4 mol B
(4)将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”“=”或“<”)
(5)一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”“变大”“变小”或“无法确定”)。
有浓度均为0.1 mol·L-1的盐酸、硫酸和醋酸三种溶液,试分析:
(1)若溶液的C(H+)分别为a、b、c,则它们的大小关系是 (用“>”“<”“=”表示),
(2)分别用三种酸中和等物质的量的氢氧化钠溶液,所需溶液的体积分别是a、b、c, 则它们的大小关系是 (用“>”“<”“=”表示)。
(3)等体积的三种酸分别与足量的锌粒反应,在相同条件下若产生气体的体积分别为a、b、c,则它们的关系是 。
(4)可逆反应2Cl2(g)+2H2O(g) 4HCl(g)+O2(g) △H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g) △H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率__________; ②保持容器体积不变,加入He,则HCl的物质的量__________;③保持容器压强不变,加入He,则O2的体积分数__________。
(1)在25℃、101kPa下,1g CH4(g)完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出该反应的热化学方程式:_ _
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其热化学方程式为__
(3)已知拆开1mol H—H键、1mol N—H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______________________
(4)已知热化学方程式:
① C2H2(g) +5/2O2(g) ="=" 2CO2(g)+H2O(l)ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) ="=" CO2(g)△H2=-393.5 kJ•mol-1
③ H2(g)+  O2(g) ="=" H2O(1)△H3 =" -285.8" kJ·mol-1
O2(g) ="=" H2O(1)△H3 =" -285.8" kJ·mol-1
则反应④ 2C(s)+ H2(g) ="=" C2H2(g)的△H为