在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=__ __。已知:K(300℃)>K(350℃),则该反应正反应是__ _热反应。升高温度,正反应速率 (填“增大”、“减小”或“不变”)。
(2)下图中表示NO2的变化的曲线是____。用O2表示从0~2 s内该反应的平均速率v(O2)=______。
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:298K时,
C(s,石墨)+ O2(g)= CO2(g)△H1= -393.5kJ/mol
2H2(g)+ O2(g)==2H2O (l)△H2= -571.6kJ/mol
2C2H2(g)+ 5O2(g)==4CO2(g) + 2H2O (l)△H3= -2599kJ/mol
写出298K时C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学反应方程式:_____________
在容积为10L的密闭容器中通入一定量的SO2和O2,450℃时发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示。请回答下列问题:
2SO3(g)(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示。请回答下列问题: (1)0~4 min的平均反应速率v(SO2)= mol·l-1·min-1
(1)0~4 min的平均反应速率v(SO2)= mol·l-1·min-1
(2)在图中画出SO3的物质的量浓度随时间的变化曲线。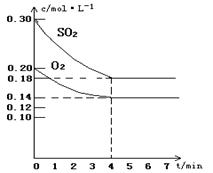
(3)在其他条件不变,7min时分别改变下列条件,将改变条件的瞬间正、逆反应速率的变化情况(“增大”、“减小”或“不变”)填入下表空格内:
| 改变的条件 |
V正 |
V逆 |
| ①增大O2的浓度 |
增大 |
|
| ②减小SO3的浓度 |
减小 |
|
| ③缩小容器的体积 |
增大 |
|
| ④加入V2O5作催化剂 |
增大 |
|
| ⑤压强不变充入He气体 |
减小 |
人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学
技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作时电子从________极流向________极(填“Ag2O”或“Zn”)。其用到的电解质溶液是(填“KOH ”或"H2SO4")
②电极反应式:正极____________________________________________,
③工作时电池电解质溶液pH________(填“增大”、“减小”或“不变”)。
(2) 2009年10月,中国科学院长春应用化学研究所在甲醇(CH3OH一种可燃物)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如右图所示。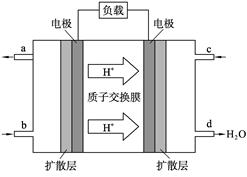
①该电池工作时,b口通入的物质为____________, c口通入的物质为__________。
②该电池正极的电极反应式___________
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。
有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝
片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1
的NaOH溶液中,如下图所示。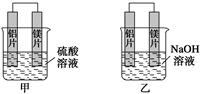
(1)写出甲池中正极的电极反应式:
正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极:________________________________________________________________。
(3)甲同学又将硫酸溶液换为浓硝酸发现有红棕色气体产生,则原电池的正极的电极反应式为
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些正确结论?( )
| A.利用原电池反应判断金属活动顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动顺序表已过时,已没有实用价值 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
(6)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_________________________________________________________________(如可靠,此空可不填)。
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。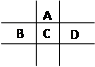
回答下列问题:
(1)A原子结构示意图。
(2)B的最高价氧化物的水化物的化学式为,
C的元素名称为,
A、C、D、E四种元素形成的简单离子的半径大小顺序为(用离子符号表示)(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
,
有关反应的离子方程式为