将铜粉放入稀硫酸中,加热无明显变化,但加入某盐后发现铜粉质量明显减少,则该盐不可能是
| A.Fe2(SO4)3 | B.NaCl | C.KNO3 | D.Cu(NO3)2 |
某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g) 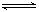 cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是()
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是()
| A.平衡正移 | B.(a+b)>(c+d) |
| C.Z的体积分数变小 | D.X的转化率变大 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中正确的是()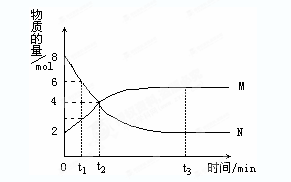
A.反应的化学方程式为:2M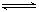 N N |
B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 | D.t1时,N的浓度是M浓度的2倍 |
某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时c(X2)=0.4mol·L-1、c(Y2)=0.8mol·L-1、c(Z)=0.4mol·L-1,则该反应的反应式是()
A.X2+2Y2 2XY2 2XY2 |
B.2X2+Y2 2X2Y 2X2Y |
C.3X2+Y2 2X3Y 2X3Y |
D.X2+3Y2 2XY3 2XY3 |
已知:(1)Zn(s)+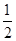 O2(g)===ZnO(s),ΔH=" -348.3" kJ·mol-1,
O2(g)===ZnO(s),ΔH=" -348.3" kJ·mol-1,
(2)2Ag(s)+ 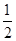 O2(g)===Ag2O(s),ΔH=" -31.0" kJ·mol-1,则Zn(s)+ Ag2O(s) ===ZnO(s)+ 2Ag(s)的ΔH等于()
O2(g)===Ag2O(s),ΔH=" -31.0" kJ·mol-1,则Zn(s)+ Ag2O(s) ===ZnO(s)+ 2Ag(s)的ΔH等于()
| A.-317.3 kJ·mol-1 | B.-379.3 kJ·mol-1 | C.-332.8 kJ·mol-1 | D.317.3 kJ·mol-1 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ•mol-1、285.8 kJ•mol-1、890.3 kJ•mol-1、2 800 kJ•mol-1,则下列热化学方程式正确的是()
A.C(s)+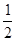 O2(g) ===CO(g) △H=-393.5 kJ•mol-1 O2(g) ===CO(g) △H=-393.5 kJ•mol-1 |
| B.2H2(g)+O2(g) ===2H2O(g) △H=+571.6 kJ•mol-1 |
| C.CH4(g)+2O2(g) ===CO2(g)+2H2O(g) △H=-890.3 kJ•mol-1 |
D.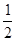 C6H12O6(s)+3O2(g) ===3CO2(g) +3H2O(l) △H=-1 400 kJ•mol-1 C6H12O6(s)+3O2(g) ===3CO2(g) +3H2O(l) △H=-1 400 kJ•mol-1 |