下列离子方程式书写正确的是
| A.钠和冷水反应: Na+2H2O=Na++2OH—+H2↑ |
| B.铁粉投入到硫酸铜溶液中:Fe+Cu2+ =Fe2++Cu |
| C.AlCl3溶液中加入足量的氨水:Al3++ 3OH=Al(OH)3↓ |
| D.澄清石灰水跟稀硝酸反应: Ca(OH)2+2H+ =Ca2++2H2O |
铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是
| A.都有H2O生成 | B.都有H2生成 |
| C.都有AlO2-生成 | D.都有Al3+生成 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,22.4L酒精含有的分子数为 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+ 离子数为0.01 NA |
| C.11.2 L H2所含的电子数为NA |
| D.通常状况下,NA 个CO2分子含有原子数为3NA |
下面关于下图所示实验装置的使用方法中叙述正确的是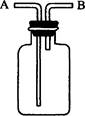
①用于排水集气:充满水,B进气,A排放水
②用于收集密度比空气大的气体:B进气,A排放空气
③用于收集密度比空气小的气体:B进气,A排放空气
④用于洗气:装入洗液,A进气,B出气
| A.全正确 | B.②③④ | C.①②④ | D.①③④ |
下列离子方程式书写正确的是
| A.铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2-+3H2↑ |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓ |
| C.三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D.FeCl2溶液跟Cl2反应:Fe2++Cl2 = Fe3++ 2Cl- |
下列各组离子中,在强碱性溶液中一定能共存的是
| A.Na+、Fe2+、Clˉ、SO42ˉ | B.Na+、K+、SO42ˉ、Clˉ |
| C.K+、Na+、HCO3ˉ、NO3ˉ | D.K+、Clˉ、Al3+、CO32ˉ |