.甲、乙为短周期元素的单质,丙、丁为氧化物,它们存在如下转化关系: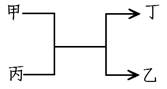
则甲和乙可以是
| A.钠和氢气 | B.镁和碳 |
| C.氧气和硫 | D.铝和铁 |
反应CO(g)+2H2(g)  CH3OH(g)过程中的能量变化情况如右图所示,曲线I和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
CH3OH(g)过程中的能量变化情况如右图所示,曲线I和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是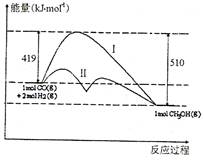
| A.该反应的△H=" +91kJ/mol" |
| B.加入催化剂,该反应的△H 变小 |
| C.反应物的总能量大于生成物的总能量 |
| D.如果该反应生成液态CH3OH,则△H变大 |
可逆反应A(g) + 3B(g)  2C(g);△H < 0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件到下达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述错误的是()
2C(g);△H < 0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件到下达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述错误的是()
A.甲中A的转化率为75%
B.甲、乙中C的体积分数相同
C.平衡后再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向生成C的方向移动
D.乙中的热化学反应方程式为2C(g) A(g)+3B(g);△H=+3Q2 kJ·mol-1
A(g)+3B(g);△H=+3Q2 kJ·mol-1
下列关于电解质溶液中离子关系说法中错误的是()
| A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液: c(NaOH) < c(Na2CO3) < c(CH3COONa) |
| B.pH = 2的HA溶液与pH = 12的MOH溶液任意比混合: c(H+) + c(M+) = c(OH-) + c(A-) |
| C.在pH=13的Na2S溶液中,Al3+、Cl-、CH3COO-不能大量共存 |
| D.由水电离出的氢离子浓度为10-1mol/L的溶液中,SO32-、NO3-、Cl-、Na+可能大量共存 |
下列反应的离子方程式正确的是()
| A.碳酸钙溶于醋酸中:CaCO3 + 2H+= Ca2++ H2O + CO2↑ |
| B.硫化钠溶液中加入硫酸铜溶液:S2-+ Cu2++ 2H2O = Cu(OH)2↓+ H2S↑ |
| C.氢氧化钠溶液中加入少量碳酸氢钡溶液: Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O |
| D.亚硫酸钠的水解:SO32-+ H2O = HSO3-+ 2OH- |