利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
| A.电解时以精铜作阳极 |
| B.电解时阴极发生氧化反应 |
| C.粗铜连接电源负极,其电极反应是Cu-2e-===Cu2+ |
| D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |
如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol·L-1,工作一段时间后,测得导线中均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述中不正确的是( )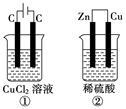
| A.电极上产生气体的体积:①=②(相同条件) |
| B.①和②中溶液的pH都减小 |
| C.电极上析出物质的质量:①>② |
| D.发生氧化反应的电极为:①中阳极,②中负极 |
铜锌原电池(如下图)工作时,下列叙述正确的是( )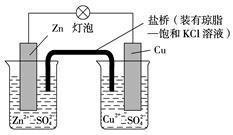
| A.正极反应为:Zn -2e-===Zn2+ |
| B.电池反应为:Zn+Cu2+=== Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+ 移向ZnSO4溶液 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+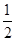 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
B.反应①中的能量变化如下图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应CH3OH(l)+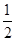 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,将1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式书写正确的是( )
| A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1 |
| B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1 |
| C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1 |
| D.2CO2(g)+2NaOH(l)===2NaHCO3(l) ΔH=-(8x-2y)kJ·mol-1 |