下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100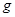 5.00%的NaOH溶液、足量的CuSO4溶液和l00
5.00%的NaOH溶液、足量的CuSO4溶液和l00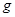 10.00%的K2SO4溶液.电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
10.00%的K2SO4溶液.电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
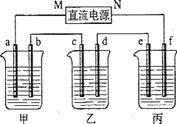
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③电极b上生成的气体在标准状况下的体积: ;﹙精确到小数点后一位小数﹚
④电极c的质量变化是增加 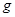 ;
;
(10分)用98%的浓硫酸(其密度为1.84g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,
(1)经计算,应用(填仪器名称及规格,下同)取浓硫酸。
(2)配制操作可分解成如下几步,以下正确的操作顺序是____________________________
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(3)所需仪器除烧杯、玻璃棒、量筒外还需 __________、 __________。
(4)玻璃棒在整个实验中的作用是、。
(5)由于错误操作, 使得到的浓度数据比正确的偏大的是__________________(填写序号)。
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用
(1)现有以下物质:①NaCl晶体②液态SO3③液态的醋酸④汞⑤BaSO4固体 ⑥蔗糖(C12H22O11)⑦酒精(C2H5OH)⑧熔化K2SO4请回答下列问题(用序号):
①以上物质中属于电解质的是_____________
②以上物质中属于非电解质的是______________
(2)碘元素的一种核素 I可用于治疗肿瘤。该核素的质子数为_________,中子数为___________,质量数为______________,核外电子数为__________________。
I可用于治疗肿瘤。该核素的质子数为_________,中子数为___________,质量数为______________,核外电子数为__________________。
(3)在一定条件下,21.6gA单质与1.20molCl2完全反应,生成0 .800molAClx,则X=____________,A的摩尔质量为_______________。
.800molAClx,则X=____________,A的摩尔质量为_______________。
(4)有反应如下:Al2O3 + N2 + 3C="=2AlN" + 3CO
①标出该反应中电子转移的方向和数目。
②在该反应中,氧化剂是____________,还原剂是__________________.
某同学用10 mol·L-1的浓盐酸配制250mL 1 mol·L-1的稀盐酸,并进行有关实验。请回答下列问题:
⑴ 需要量取浓盐酸________ mL。
⑵配制该稀盐酸时使用的仪器有______mL量筒(量筒可供选择的规格有10mL.,30mL,50mL,100mL)、烧杯、玻璃棒,还必须用到的玻璃仪器有______________、______________。
⑶定容时应在______________处改用______________(实验仪器)滴加至。
⑷ 取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为________ 克,设反应后溶液的体积仍为100mL,则反应后溶液中的氢离子的物质的量浓度为______________
(4分)某待测液中可能含 有A13+、Cu2+。。K+、NH4+ .C1-——等离子,现通过如下实验对其中的阳离子进行检验:——
有A13+、Cu2+。。K+、NH4+ .C1-——等离子,现通过如下实验对其中的阳离子进行检验:——
(1)取少量待测液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解。实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是,一定没有的阳离子是。还有一种阳离子没有检验,检验这种离子的实验方法是,确定该离子存在的现象是。
(1)(5分)下列常用物质:
| A.碳酸氢钠 | B.阿斯匹林 | C.葡萄糖 | D.苯甲酸钠 E.柠檬黄 |
请用字母填空:
具有解热镇痛疗效的是________,可直接进入人体血液补充能量的是________ ,可用作食品防腐剂的是________,常用作食品着色剂的是________,常用作治疗胃酸过多的抗酸剂的是________。
(2)人体健康与食品、药物等关系密切。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取______________(选填“脂肪”、“维生素”或“蛋白质”)不足引起的。
②生活中应合理地摄取人体必需的元素,体内________含量过高,会引起甲状腺疾病。
③糖类、油脂、蛋白质都是人体必需的营养物质。其中蛋白质被摄入人体后,在酶的作用下水解为_______________________(写名称)。
④小苏打可用来治疗胃酸过多,请写出该反应的离子方程式
___________________________________________________。
⑤可以帮助流感病人解热镇痛的药物是______________(选填“青霉素”或“阿司匹林”)。
(3)(4分)下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品 名 |
××× |
| 配 料 |
鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
| 保质期 |
240天 |
| 生产日期 |
标于包装袋封口上 |
①富含蛋白质的是___________________,②富含糖类的是_______________________,
③富含油脂的是_____________________,④富含维生素的是_____________________。