下列实验装置不能达到实验目的的是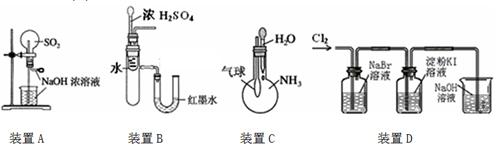
| A.用装置A来做SO2的喷泉实验 |
| B.用装置B来验证浓H2SO4与水混合的热量变化 |
| C.用装置C来验证NH3易溶于水 |
| D.用装置D来验证氧化性:Cl2>Br2>I2 |
人类对赖以生存的地球环境的保护问题越来越重视,如何减少或取代高污染的化学品的使用,一直是许多化学家奋斗的目标。碳酸二甲酯(简称DMC)是一种新化工原料,2008年在欧洲被誉为“非毒性化学品”。其结构如下图。下列关于DMC的说法中正确的是
A.DMC可以认为是1 mol碳酸和2 mol甲醇反应生成
B.DMC在空气不能燃烧 C.DMC易溶于水,不溶于乙醇和丙酮
C.DMC易溶于水,不溶于乙醇和丙酮
D.1 mol DMC与足量的NaOH溶液反应,最多可以可以消耗4 mol NaOH
有关甲烷,甲醇,甲醚,甲醛,甲酸的叙述正确的是
①1 mol甲烷与等物质量的Cl2在光照条件下反应生成1 mol一氯甲烷
②能够与金属钠反应的有甲醇和甲酸
③0.1 mol上述各有机物的混合物充分燃烧,生成标准状况下的CO2 2.24 L
④以上五种有机物,能够在一定条件下发生银镜反应的仅有甲醛
⑤常温常压下,呈气态的有甲烷、甲醛和甲醚
⑥150℃时,各有机物分别与足量的氧气混合并充分燃烧,维持原来的温度和压强,甲烷燃烧前后体积不变
| A.②③⑤ | B.②⑤⑥ | C.②④⑤ | D.①③⑤ |
有机物甲分子式为C11H14O2,在酸性条件下水解得到乙和丙,丙遇FeCl3显紫色,丙的相对分子质量比乙大20,甲的结构有
| A.3种 | B.4种 | C.6种 | D.8种 |
某混合气体由烯烃A和某烃B组成。现将1.0 L该混合气体在氧气中充分燃烧,生成2.0 L二氧化碳和2.4 L水蒸气(在相同条件下测定)。则混合气 体
体 的组成及其体积比是
的组成及其体积比是
| A.V(烯烃)∶V(烷烃) =" 3∶2" | B.V(烯烃)∶V(烯烃) = 3∶2 |
| C.V(烯烃)∶V(炔烃) =" 3∶2" | D.无法计算 |
下列工业生产的有关说法正确的是
| A.石油的分馏和干馏都是复杂的物理变化和化学变化 |
| B.工业上生产酒精,可以用发酵法和乙烯水化法 |
| C.工业生产聚氯乙烯的反应原理是利用缩聚反应 |
| D.石油裂解气能使溴水褪色,但不能使酸性高锰酸钾褪色 |