实验室以含有Ca2+、Mg2+、Cl—、SO42—、I—等离子的卤水为主要原料,制备无水CaCl2和I2。流程如下: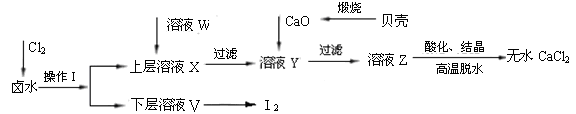
(1)操作Ⅰ的方法是 ,所用主要仪器的名称是 。
(2)加入溶液W的目的是除去SO42-。用CaO调节溶液Y的pH,可以除去Mg2+。酸化溶液Z时使用的试剂是______。从溶液V中再得到I2的操作方法是 。
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是 。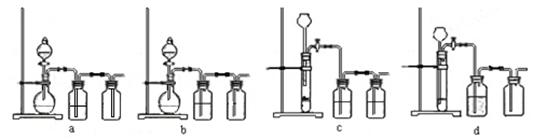
(4)模拟以下净化Cl2流程:Cl2 →饱和NaCl溶液 → 浓H2SO4→纯净Cl2
设计合理实验验证H2SO3酸性强于H2CO3。
供选的试剂:CO2、SO2、Na2CO3溶液、NaHCO3溶液、NaHSO3溶液、蒸馏水、澄清石灰水、酸性KMnO4溶液、品红溶液、pH试纸。
SO2→ → → → 。
B.[实验化学]茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华。另外茶叶中还含有11% ~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿。现从茶叶中提取咖啡碱流程如下:
步骤I:称取一定量的茶叶,放入下图所示提取器的滤纸筒中,在圆底烧瓶中加入95%乙醇,用水浴加热,连续提取1.5小时。
步骤Ⅱ:待冷凝液刚刚虹吸下去时,立即停止加热。稍冷后,改成蒸馏装置,回收提取液中的大部分乙醇。
步骤Ⅲ:趁热将瓶中的残液倾入蒸发皿中,拌入3 ~ 4g生石灰粉使成糊状,低温蒸干,并压碎块状物。
步骤Ⅳ:取一只口径合适的玻璃漏斗,罩在隔以刺有许多小孔滤纸的蒸发皿上,小心加热升华,控制温度在180℃左右。当滤纸上出现大量白色毛状结晶时,停止加热,使其自然冷却,收集升华所得咖啡因。
回答下列问题:
(1)实验之前需要将茶叶研磨成粉末状,其目的是。
(2)溶解抽提时不选择氯仿直接将咖啡碱提取而选用乙醇的原因是。
(3)提取器中虹吸管的作用是。
(4)冷凝器中冷却水从进出(选填“a”或“b”)。
(5)生产过程中可循环使用的物质是。
(6)在粗产品中加入生石灰的原因是。
(15分)乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下: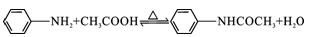
已知:
①苯胺易被氧化。
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 |
熔点 |
沸点 |
溶解度 |
| 乙酰苯胺 |
114.3℃ |
305℃ |
微溶于冷水、易溶于热水 |
| 苯胺 |
-6℃ |
184.4℃ |
微溶于水 |
| 醋酸 |
16.6℃ |
118℃ |
易溶于水 |
实验步骤如下: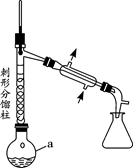
步骤1:在a中,加入9mL (0.10 mol)苯胺、15 mL(0.27 mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全。
步骤3:趁热将反应混合物倒入盛有100 mL 冷水的烧杯中,冷却后抽滤(一种快速过滤方法)、洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)仪器a的名称为,所选仪器a的最佳规格是(填序号)。
A.25 mLB.50 mL C.100 mLD.250 mL
(2)实验中加入少许锌粉的目的是。
(3)步骤2中,控制温度计读数在105℃左右的原因是。
(4)判断反应已基本完全的方法为。
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是。
(6)步骤4中粗产品进一步提纯,该提纯方法是。
(7)本次实验的产率为。
实验室以苯、乙醛为原料,三氯化铝为催化剂来制备1,1—二苯乙烷,其反应原理为: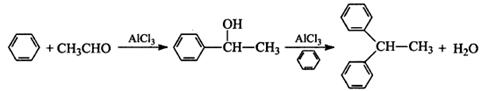
制备过程中其他产物会与AlCl3发生副反应。主要实验装置和步骤如下: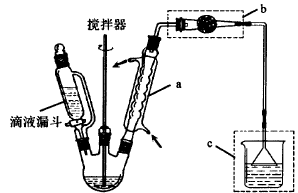
I.合成:
在250 mL三口烧瓶中加入140mL苯(密度0.88g/mL)、19gA1C13和5.5g乙醛,在20℃时充分反应。
Ⅱ.分离与提纯:
将反应混合物倒入装有150 mL,冰水和少量盐酸的烧杯中,充分搅拌,用分液漏斗分离出有机层,依次用水、2%碳酸钠溶液、水洗涤,在分离出的粗产品中加入少量无水硫酸镁固体,过滤后先常压蒸馏除去过量苯再改用减压蒸馏收集170~172℃/6.67kPa的馏分,得12.5g 1,l—二苯乙烷。
(1)仪器a的名称:;其他产物与A1C13发生副反应的化学方程式为:;装置C的作用:。
(2)连接装置b的作用是。
(3)在洗涤操作中,第二次水洗的主要目的是 。实验中加入少量无水硫酸镁的目的是。
(4)粗产品常压蒸馏提纯时,下列装置中温度计位置正确的是,可能会导致收集到的产品中混有低沸点杂质的装置是。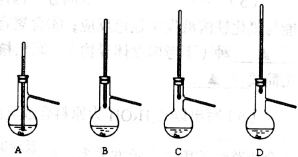
(5)本实验所得到的1,1—二苯乙烷产率约为(填正确答案的序号)。
| A.41% | B.48% | C.55% | D.65% |
(14分)BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如图所示。请回答:
已知:室温时Ksp[Mg(OH)2 ]=1.8×10-11,Ksp[Fe(OH)3 ]=4.0×10-38
(1)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通人空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓人预热后的空气吹出,预热空气的目的是_________;沉淀A的主要成分是_________。
(3)热空气吹除时会有部分HS-转变为S2O32-,使产品仍不能达到纯度要求,可再行酸化脱硫,酸化脱硫时的离子方程式为_________。
(4)室温时,为使Mg2+、Fe3+完全沉淀(当溶液中离子浓度小于1×l0-5mol 时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
(5)实验室测定产品中x的步骤如下:
①准确称取12.23 g BaCl2·xH2O样品,加入l00 mL稀盐酸加热溶解;
②边搅拌,边逐滴加入0.lmol H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
③将沉淀充分干燥后称量,质量为11.65 g,检验BaSO4沉淀是否洗涤干净的方法是_______;经计算x的数值为_________。
(15分)颗粒大小达到纳米级的单质铁俗称“纳米铁”,可用作手机辐射屏蔽材料。实验室的制备方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2反应生成“纳米铁”,实验装置如下图。请回答: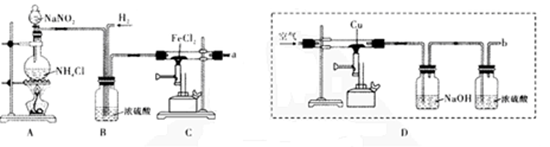
(1)A装置用于制取氮气,反应的化学方程式为_________。
(2)实验时,应先将____(填“N2”或“H2”)通入C装置,反应生成“纳米铁”的化学方程式为;实验中需要保护气的原因是_________。
(3)a导管口的气态产物除HC1外还可能有_________(填化学式)。
(4)利用D装置也可以得到较纯净的氮气。但科学家发现,采用此方法在b导管口得到的氮气在相同条件下比原方法得到的氮气密度略大,原因是_________(假设上述实验设计与操作均无错误,且氮气已完全干燥);若开始加入的铜粉质量为3.84 g,持续通人空气至铜粉全部反应,冷却后固体质量为4.48 g,则固体的成分为_________,反应的化学方程式为_____.