下列实验操作中,正确的是
| A.过滤时,玻璃棒紧靠一层滤纸的那一边 |
| B.配制一定物质的量浓度溶液时,直接用烧杯向容量瓶加水至刻度线 |
| C.检验某溶液中是否含有钾离子:用洁净的铂丝蘸取待测溶液,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色 |
| D.用自来水制蒸馏水时,加热一段时间后,发现未加沸石,立即打开烧瓶加入几粒沸石 |
丁腈橡胶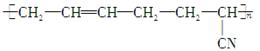 具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是:
具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是: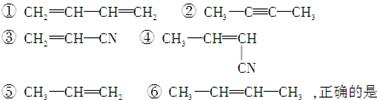 ()
()
| A.③⑥ | B.②③ | C.①③ | D.④⑤ |
在高科技工业上,有的高分子材料能用在能量的转换上。如传感膜能把化学能转化为电能,热电膜能把热能转化为电能等,这种高分子材料是
| A.高分子膜 |
| B.医用高分子材料 |
| C.生物高分子材料 |
| D.液晶高分子材料 |
化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A.日本福岛第一核电站核泄漏的具有放射性的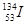 、 、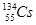 可能持续影响数十年。其中 可能持续影响数十年。其中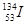 的中子数比 的中子数比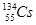 的中子数少1 的中子数少1 |
| B.我国部分城市已陆续开始推广使用“甲醇汽油”。“甲醇汽油”具有降低排放、节省石油、安全方便等特点。 |
| C.“反式脂肪酸”对人类健康危害极大,它的形成是由于油脂氢化过程中双键的顺式结构转变成室温下更稳定的固态返工结构 |
| D.废弃的塑料、金属、纸制品是可回收利用的资源,而玻璃是不可回收再利用 |
加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用图所示装置探究废旧塑料的再利用。下列叙述不正确的是( )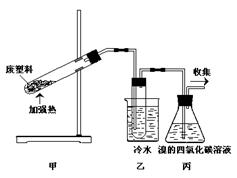
| A.聚丙烯的链节是—CH2—CH2—CH2— |
| B.装置乙的试管中可收集到芳香烃 |
| C.装置丙中的试剂可吸收烯烃以制取卤代烃 |
| D.最后收集的气体可做燃料 |
下列叙述中,正确的是( )
①开发使用新型清洁能源,减少化石燃料的燃烧,可从根本防止酸雨的产生。
②我国从2000年起逐渐用二氧化氯代替氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,功效长。
③氧化铝可用来制造耐火砖和坩埚等。
④明矾能使水中的悬浮物凝聚,可作净水剂。
⑤建设三峡大坝使用大量水泥,水泥是硅酸盐材料。
⑥戴上浸有浓NaOH溶液的口罩,防止氯气中毒。
| A.①④⑤ | B.①②④⑤ | C.除⑥外 | D.全部 |