下列关于乙酰水杨酸(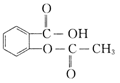 )说法正确的是
)说法正确的是
| A.能发生水解反应 | B.能发生消去反应 |
| C.不能发生酯化反应 | D.不能发生加成反应 |
已知在溶液中,还原性:HSO3—> I—,氧化性:IO3—> I2 > SO42—。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则下列说法错误的是
I—,氧化性:IO3—> I2 > SO42—。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则下列说法错误的是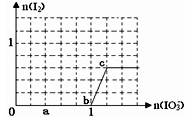
| A.a点时NaHSO3过量 |
| B.b点时的还原产物为I— |
C.b点到c点,KIO 3与NaHSO3反应生成I2 3与NaHSO3反应生成I2 |
| D.加入的KIO3为0.4 mol 或1.12 mol时,I—均为0.4 mol |
下列离子方程式与所述事实相符且正确的是
A.用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I- I2+2OH- I2+2OH- |
B.高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl- 2Mn2++5Cl2↑+8H2O 2Mn2++5Cl2↑+8H2O |
C.AlCl3溶液中滴加过量氨水:Al3++4NH3·H2O AlO2—+4NH4++2H2O AlO2—+4NH4++2H2O |
D.漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O CaCO3↓+2HClO CaCO3↓+2HClO |
CaC2是离子型金属碳化物,容易发生水解反应,生成乙炔和氢氧化钙。现有ZnC2、Al4C3、Mg2C3、Li2C2等,同属于离子型金属碳化物,也很容易发生水解反应。请从CaC2跟H2O反应生成C2H2的反应过程进行思考,从中得到必要的启示,判断下列物质的水解产物是C3H4的是
| A.ZnC2 | B.Al4C3 | C.Mg2C3 | D.Li2C2 |
向等量的NaOH溶液中分别通入CO2气体。因CO2的通入量不同,得到组分不同的溶液M。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)关系如下,(注:①假设CO2全部逸出;②C图中oa=ab)。其中M中只有1种溶质的是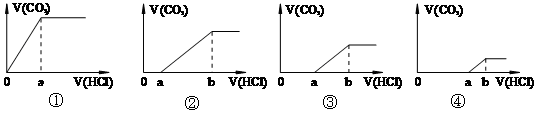
| A.只有① | B.只有③ | C.②④ | D. ①③ ①③ |
向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL l mol·L—1的盐酸,恰好使混合物完全溶解并放出标准状况下224mL气体,向所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为
| A.11.2g | B.5.6g | C.2.8g | D.无法计算 |