(1 3分)亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体在中性和碱性溶液中不能稳定存在。
回答下列问题:
(1)在无隔膜电解槽中用惰性电极电解一段时间,阳极电极反应方式为 ;生成ClO2气体的反应中所加X酸为 。
(2)吸收塔内的温度不宜过高的原因为 ;ClO2吸收塔内发生反应的离子方程式为 。
(3)从溶液中得到NaClO2·3H2O粗晶体的实验操作名称依次是 ;粗晶体进一步提纯的实验操作名称是 。
(4)a kg 30% H2O2理论上可最多制得 kg NaClO2 ·3H 2O
以下是一些元素的信息,其中有一种元素不在短周期。
| 元素A |
元素B |
元素C |
元素X |
元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 |
基态原子M层p轨道上有5个电子 |
短周期中金属性最强,与X反应能生成两种常见化合物 |
最外层电子数是内层电子数的3倍,能形成双原子阴离子 |
单质为双原子分子,结构中 键与 键与 数目比为1:2 数目比为1:2 |
根据上述信息回答下列问题:
(1)写出A元素基态原子的核外电子排布式。
(2)B、C、X的简单离子半径由大到小的顺序为(填离子符号)。
(3)H−X与H−Y两种共价键中,键的极性较强的是,键长较长的是
(X、Y用元素符号表示)。
(4)X、Y二种元素第一电离能从大到小的顺序是(填元素符号);Y的常见氢化物易液化的主要原因是。
(5)X常见氢化物的蒸气与A 的粉末在高温条件下充分反应,生成一种黑色磁性固态化合物和一种气体单质,此反应的化学方程式是。
Ⅰ在催化剂作用下,CO2和H2可以制取甲醇。用工业废气中的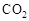 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:。
Ⅱ硼氢化钠(NaBH4)是有机合成中的重要还原剂。最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题: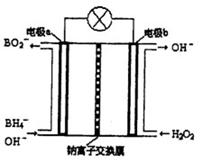
(1)电极b为(填“正极”或“负极”),电极a上发生反应的电极反应式为。
(2)电池工作时,Na+向极(填“a”或“b”)移动,当左槽产生0.0125molBO2—离子时,右槽溶液pH=
(3)用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1molCu(OH)2,溶液恢复到电解之前状态,则电解过程中转移电子数目为_________
二氧化钛(TiO2)广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到胶体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
②检验TiO2·x H2O中Cl-是否被除净的方法是______________________________
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
(2)钛铁矿粉末中加硫酸反应得TiO2+的离子方程式为
(3)溶液甲中加入Fe的作用是
(4)若要加热FeSO4.7H2O晶体得无水硫酸亚铁,除酒精灯、玻璃棒外,还要用到的两种硅酸盐质仪器是
Ⅱ二氧化钛可用于制取钛单质,涉及到的步骤如下图:
反应②的方程式是,该反应需要在Ar气氛中进行,请解释原因:_
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满。用化学式或化学符号回答下列问题: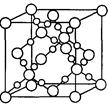
(1)G的基态原子的外围电子排布式为,周期表中F属于区。
(2)B与F形成的一种非极性分子的电子式为;F的一种具有强还原性的氧化物分子的VSEPR模型为
(3)BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于_______
(选填“分子”、“原子”、“离子”或“金属”)晶体
(4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液②pH=3的乙的水溶液③pH=3的丙溶液,3种溶液中水电离出的cH+之比为
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4混合后,溶液中各离子浓度大小顺序为
(6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:___________________________
(7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是_____
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为________。
②BH4-的空间构型是________(用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
| A.NH3分子中N原子采用sp3杂化 |
| B.相同压强时,NH3沸点比PH3高 |
| C.[Cu (NH3)4]2+离子中,N原子是配位原子 |
| D.CN-的电子式为[:C┇┇N:]- |
(3)2008年,Yoon等人发现Ca与C60(分子结构如图)生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,C60是________分子(填“极性”或“非极性”)。
②1 mol C60分子中,含有σ键数目为________。
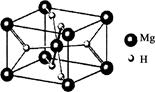
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为________cm3[a、NA表示(NA表示阿伏加德罗常数的值)]。