实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是
| A.此实验表明氯水具有酸性、漂白性 |
| B.内环呈白色外环呈红色或浅红色 |
| C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快 |
| D.氯水中形成次氯酸的反应中还原产物是HClO |
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:N2 (g)+3H2 (g)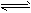 2NH3 (g),△H=" -" 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
2NH3 (g),△H=" -" 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系 能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量:23.15kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是
A.容器②中达平衡时放出的热量Q="23." 15kJ
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器①、②中反应的平衡常数相等
D.若容器①体积为0.5L,则平衡时放出的热量小于23. 15kJ
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列说法中错误的是
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.图中两处硫酸的质量分数b>a |
| C.该过程中的产品主要为H2SO4和H2 |
| D.阳极区pH增大 |
天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li 被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为CoO2+LiC6 LiCoO2+C6,下列说法正确的是
LiCoO2+C6,下列说法正确的是
| A.充电时,电池的阳极反应为LiC6 — e— = Li+ + C6 |
| B.放电时,电池的正极反应为 CoO2 +Li++ e— = LiCoO2 |
| C.乙酸、乙醇等含活泼氢的有机物可做该锂离子电池的电解质 |
| D.该锂离子电池的比能量(消耗单位质量电极所释放的电量)比铅蓄电池低 |
现有0.1 mol·L-1的醋酸溶液,下列说法正确的是
| A.加水稀释,溶液中所有离子的浓度都减小 |
| B.溶液中n(CH3COO— )+n(CH3COOH)=0.1mol |
| C.升高温度,醋酸的电离度增大 |
| D.中和1L等物质的量浓度的NaOH溶液所消耗的醋酸体积大于1L |
下列说法正确的是
| A.金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属甲比金属乙活泼 |
| B.原电池中电子从负极经过溶液流向正极 |
| C.电解池中电解质溶液的阳离子向阴极迁移 |
| D.在铁制品上镀银,铁做正极,银做负极 |