下列叙述正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 |
| B.25℃时Ksp(AgCl)=1.8×10—10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大 |
| C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4 |
| D.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸 |
1mol某烃能与2mol HCl完全加成,其产物最多能被8mol Cl2完全取代,则原烃可能为( )
| A.乙炔 | B.环丁烯 | C.1一丙炔 | D.1,3一丁二烯 |
鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌作用。已知角鲨烯分子有30个碳原子,其中有6个碳碳双键,且不含环状结构,则其分子式为
A.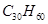 |
B.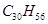 |
C.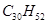 |
D.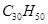 |
下列实验能成功的是
| A.将乙酸和乙醇混合加热制乙酸乙酯 |
| B.苯和浓溴水反应制溴苯 |
C.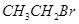 中滴加 中滴加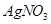 溶液观察是否有浅黄色沉淀,判断卤代烃的类型 溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
D.用 溶液和过量 溶液和过量 溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 |
能在KOH的醇溶液中发生消去反应的是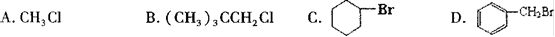
下列有机物中加入溴水,充分振荡后静置,观察到水层变为无色,有机溶液层为橙黄色,该有机物是
| A.苯 | B.1-己烯 | C.1,3-丁二烯 | D.乙醛 |