阅读下面的科普短文
在离地面约25km高空处有一层厚度极薄的气体层,主要成分是臭氧(O3),它是地球上一切生命的保护层。
与O2不同,通常状况下O3是淡蓝色气体,有难闻的鱼腥味。O3不太稳定,一旦受热极易转化成O2,并放出大量的热。 O3比O2活泼的多,它能跟许多物质(SO2、CO、NO、氟利昂等)发生反应。如除去工业废气中的SO2,一种方法是在微热条件下,O3与SO2化合成SO3,SO3再跟H2O化合就得到了硫酸。
臭氧发生器可以制得O3,其原理是在放电条件下,O2能转化为O3。从臭氧发生器出来的气体中含O3约3%。
臭氧层能吸收太阳辐射中的大量紫外线,使地球上的生物免遭紫外线的伤害。飞机排出的废气(含CO、NO等)以及常用的制冷剂“氟利昂”会使臭氧层形成空洞,从而使更多的紫外线照到地球表面,导致皮肤癌的发病率大大增加。如不采取措施,后果不堪设想。
依据文章内容,回答下列问题:
(1)O3与O2化学性质不同的原因是 。
(2)O2转变为O3的化学方程式为 。
(3)O3与SO2反应的化学方程式为 。
(4)你认为保护臭氧层的有效方法是 。
根据所学的知识并结合下列仪器,回答有关问题: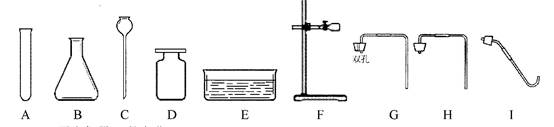
(1)写出仪器
的名称。
(2)实验室以氯酸钾为原料制取并收集氧气,完成这个实验除选用
外,还需增加的仪器是,反应的化学方程式为。
(3)实验室用石灰石和稀盐酸制取二氧化碳,组装一套气体发生装置所需的仪器是(填字母),反应的化学方程式为.
(4)通过查阅资料获知:镁在加热条件下与
均能发生反应;氮化镁(
)能与水反应;碱石灰的主要成分是生石灰和氢氧化钠固体。小强欲在实验室里以空气和镁粉为原料制取少量氮化镁。可供选择的装置和药品如下图所示: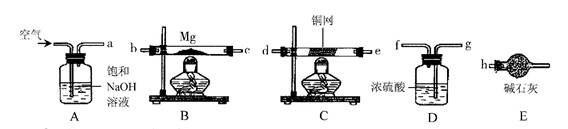
①导管口之间的连接顺序是:
→()()→()()→()()→
。
②通气后,应先点燃装置(填"
"或"
")的酒精灯,装置
的作用是.
写出下列反应的化学方程式,并在括号内注明基本反应类型:
(1)硫在氧气中燃烧,()反应。
(2)锌与稀硫酸的反应。
(3)二氧化碳使澄清石灰水变浑浊。
化学就在我们身边,它与我们的生活息息相关。
(1)下图为某食品包装袋的部分说明。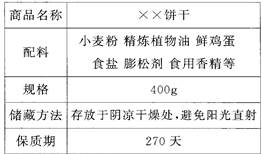
请回答下列问题:
①在饼干的配料中,富含油脂的是;
②配料中可用于腌渍蔬菜的物质是;
③小麦粉中富含糖类,糖类在人体内经过一系列的变化最终转化为水和;
④食用香精中含有香豆素(
),香豆素中碳、氢、氧三种元素的质量比为。
(2)现有
、
、
、
四种元素,请选用其中的元素写出符合下列要求的物质的化学式。
①最轻的气体;
②"西气东输"中"气"的主要成分;
③人体中含量最多的物质;
④可用作食品干燥剂的氧化物。
某地规定工业排放的废气中S02的含量不得超过0.4mg∕L。某兴趣小组利用以下反应:
,测定某工业废气中S02的含量,测试装置如图所示。
测试步骤:
①碘溶液的配制:准确称取l.27g碘单质,加入少量碘化钾,先溶解在100mL水中,继续加水配制成l000mL溶液。
②取5mL上述溶液,加入试管中,滴入2~3滴淀粉试液。
③把l00mL注射器的活塞推到底后,插入试管的橡皮塞中,如图所示。
然后缓缓向外拉,使吸入试管内的废气与淀粉碘溶液充分接触。每次抽取的气体为l00mL,重复抽取n次,直到溶液的颜色变为无色(废气中的其它成分不与淀粉碘溶液反应)。
(1)排放到空气中的S02气体主要来自于燃烧。
(2)步骤②中,5mL溶液中溶有碘单质mg,滴入淀粉试液后,溶液变为色。
(3)按步骤测试某工业废气,抽取次数为80次后,溶液刚好变为无色。试计算该废气中S02含量,并判断是否符合排放标准。
通过钝化的方式使锌制品表面形成一层保护膜,可有效防止锌的腐蚀。某锌制品的钝化液含有硝酸银、硝酸铜、重铬酸等,其中重铬酸是一种可溶性的酸。
(1)该钝化液
。 (填"
"、"
"或"
")
(2)重铬酸(
)中铬元素的化合价为。
(3)反应过程中会产生含有金属单质的细微颗粒,该颗粒中一定含有的金属是。