ZnO是电镀、涂料、有机合成等化学工业的重要原料。某课题组设计由含锌工业废料(含Fe、Cu、Mn等杂质)生产ZnO的工艺流程如下: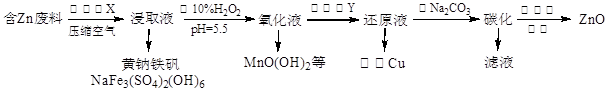
已知:黄钠铁矾在pH为1.5,温度为90℃时完全沉淀,且易于过滤。
2Cu +O2 +2H2SO4 == 2CuSO4+2H2O
(1)步骤①的浸取液里除含有Zn2+、Mn2+以外,还含有的金属离子有 、 ,所加试剂X为Na2SO4和_________的混合液。
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式_________________________,步骤③加入的试剂是_______,整个工艺流程中可以循环使用的试剂是_____________。
(3)步骤⑤中检验沉淀是否洗涤干净的操作方法是____________________________。
(4)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3·xZn(OH)2·yH2O],取该样品7.18 g,充分灼烧后测得残留物质量为4.86 g,将所得气体通入足量澄清石灰水中,得到2.00 g沉淀,则此碱式碳酸锌的化学式是________________。
按要求完成以下化学方程式:
(1)钠与水反应___________
(2)在光照下,次氯酸分解____________
(3)在高温下,铁与水蒸气反应_________
(4)铝与氢氧化钠溶液反应___________
某同学欲配制85mL 0.10 mol/L CuSO4溶液。
(1)若用100 mL容量瓶配制该溶液,应称取胆矾晶体(CuSO4.5H2O)的质量为g。
(2)在配制过程中,该同学已经有天平(带砝码)、药匙、100 mL容量瓶、玻璃棒、胶头滴管,要完成该实验还缺少的仪器是。
(3)下列情况中,能使所配溶液的物质的量浓度偏高的是。
| A.称量固体时将砝码放置在托盘天平左盘 |
| B.胆矾已失去部分结晶水 |
| C.转移溶液时有少量液体流出容量瓶外面 |
| D.定容时俯视刻度线 |
混合物A由KAl(SO4)2、Al2O3和FeO组成,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)D的化学式是,E的化学式是。
(2)写出①、②、④反应的离子方程式:
①;
②;
④。
(3)向溶液C中加入NaOH溶液并长期放置,能观察到的现象是。
(4)某种贫血症患者应补充溶液C中的金属阳离子。含该阳离子的药片外表包有一层特殊的糖衣,这层糖衣的作用之一就是保护该离子不被空气中的氧气氧化。验证长期放置的药片已经失效的方法是:将药片去除糖衣后研碎,取少量研碎的药片放入烧杯中,加适量的蒸馏水,__________(请补充完整),表明该药片已失效。
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
已知:①海水中溴元素(以Br-表示)的浓度0.068g/L;
②Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。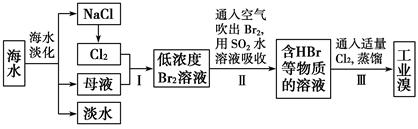
(1)请写出一种海水淡化的方法:_____________。
(2)海水中溴离子的物质的量浓度为_____________。
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br-,步骤Ⅲ又得到Br2,其目的为________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为。
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_________________________________。
下图中,A、B、C、D、E是常见单质,其中B、C、E为金属。G、H、I、F是B、C、D、E分别和A形成的化合物,G物质有磁性。已知:①C与G反应生成B和H且放出大量的热,该反应可用于焊接铁轨;②I是一种常见的温室气体,它和E可以发生反应: ,F中E元素的质量分数为60%。回答问题:
,F中E元素的质量分数为60%。回答问题: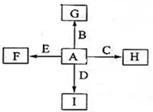
(1)C与G反应的化学方程式为;
(2)单质A的分子式为,化合物I的名称为;
(3)C与NaOH溶液反应的化学方程式为;
(4)过量I与NaOH溶液反应的离子方程式为;