利用下列实验装置图进行的相应实验,能达到实验目的的是
| A.用图1装置配制一定物质的量浓度的稀硫酸 |
| B.用图2装置可探究铁的吸氧腐蚀 |
| C.用图3装置可制取氢氧化亚铁 |
| D.用图4装置可说明浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
室温下,下列各组离子在有限定条件的溶液中一定能大量共存的是()
| A.由水电离产生的C(H+)=10﹣12 mol•L一1的溶液中:K+、NA+、Fe2+、NO3﹣ |
| B.室温下,pH=7的溶液中:Al3+、Cl﹣、HCO3﹣、SO42﹣ |
| C.室温下,pH=13的溶液中:K+、Cu2+、S2﹣、Cl﹣ |
| D.pH=13的溶液中:K+、BA2+、Cl﹣、OH﹣ |
下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是()
| A.CH3CH2CH2CH3 | B.CH3CH(CH3)2 |
| C.CH3C(CH3)3 | D.(CH3)2CHCH2CH3 |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中相差不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| KA |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
根据上述表格中的数据,判断以下说法中不正确的是()
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式可表示为H2SO4===2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
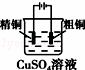
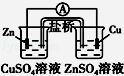
下列有关电化学装置完全正确的是()
| A |
B |
C |
D |
 |
 |
 |
 |
| 铜的冶炼 |
铁上镀银 |
防止Fe被腐蚀 |
构成铜锌原电池 |
A.A B.B C.C D.D
在电解水制取H2和O2时,为了增强溶液的导电性,常常要加入一些电解质,最好选用下列物质中的()
| A.HCl | B.NA2SO4 | C.CuSO4 | D.NACl |