【化学—物质结构与性质】
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):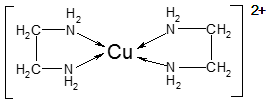
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为 ,H、N、O三种元素的电负性由大到小的顺序是 ;
(2)SO2分子的空间构型为 ;
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)配离子[Cu(En)2]2+的配位数为 ,该微粒含有的微粒间的作用力类型有 (填字母);
| A.配位键 |
| B.极性键 |
| C.离子键 |
| D.非极性键 |
E.氢键
F.金属键
(5)CuCl的晶胞结构如图所示,其中Cl-的配位数(即与Cl- 最近距离的Cu+的个数)为 。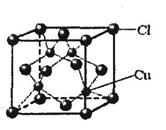
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。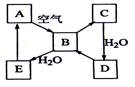
(1)写出A在加热条件下与
反应的化学方程式
(2)写出E与A的氢化物反应生成A的化学方程式_
(3)写出一个由D生成B的化学方程式
(4)将5
0.10
的E溶液与10
0.10
的
溶液混合。
①写出反应的离子方程式
②反应后溶液的 7(填"大于"、"小于"或"等于"),理由是
③加热反应后的溶液,其 (填"增大"、"不变"或"减小"),理由是
(A)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:
(1)实验1中,沉淀最终变为色,写出沉淀变色的化学方程式。
(2)实验2甲针筒内的现象是:有生成,活塞移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入溶液中。
(3)实验3中,甲中的3
气体是
和
的混合气体,那么甲中最后剩余的无色气体是,写出
与
反应的化学方程式为。
(4)实验4中,已知:
。甲针筒内活塞有移动,针筒内有白烟产生外,气体的颜色变为。最后针筒内剩余气体的体积约为
。
生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO CO2+2H2O+
CO2+2H2O+
4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1)原混合气体中甲烷的物质的量是____________。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
小苏打、胃舒、平达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.5
,2片小苏打片和胃酸完全中和,被中和的
是
。
(2)胃舒平每片含0.245
。中和胃酸时,6片小苏打片相当于胃舒平片。
(3)达喜的化学成分是铝和镁的碱式盐。
①取该碱式盐3.01
,加入2.0
盐酸使其溶解,当加入盐酸42.5
时,开始产生
,加入盐酸至45.0
时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比。
②在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74 ,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式。
北京奥运会"祥云"火炬燃料是丙烷
,亚特兰大奥运会火炬燃料是丙烯
。
(1)丙烷脱氢可得丙烯。
已知:
 +
≡
+
;△
="156.6"
-1
+
≡
+
;△
="156.6"
-1
=
 +
=
;△
="32.4"
-1
+
=
;△
="32.4"
-1
则相同条件下,反应
 =
+
的△
=
-1
=
+
的△
=
-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入
和
,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为;放电时,
2-移向电池的(填"正"或"负")极。
(3)碳氢化合物完全燃烧生成
和
。常温常压下,空气中的
溶于水,达到平衡时,溶液的
=5.60,
(
)=1.5×10-5
-1。若忽略水的电离及
的第二级电离,则
 - +
+的平衡常数
=。(已知:10-5.60=2.5×10-6)
- +
+的平衡常数
=。(已知:10-5.60=2.5×10-6)
(4)常温下,则溶液
(
)
(
-)(填">"、"="或"<"),原因是(用离子方程式和必要的文字说明)。