等物质的量的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)⇌3Z(g)+Q(s) △H >0,下列叙述正确的是:
| A.当容器中X与Y的物质的量的比满足1:2时反应达到平衡 |
| B.达到平衡时X的转化率为25%,则平衡常数K值为9/4 |
| C.达到平衡后,反应速率2V正(Y)="3" V逆(Z) |
| D.达到平衡后,加入Q,平衡逆向移动 |
下列热化学方程式表达正确的是( 的绝对值均正确)
的绝对值均正确)
| A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H="–1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H= +57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H=–269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H= +116.2kJ/mol(反应热) |
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) 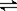 C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是
①混合气体的密度②容器内气体的压强③混合气体的总物质的量
④B物质的量浓度⑤混合气体的平均相对分子质量⑥A的转化率
| A.①②③ | B.只有③ | C.②③④ | D.①④⑤⑥ |
下列说法不正确的是
| A.化学反应过程中,一定有化学键的断裂和形成 |
| B.盖斯定律实质上是能量守恒定律的体现 |
| C.反应前后原子种类和数目不变遵循的是质量守恒定律 |
| D.需要加热才能进行的反应,一定是吸热反应 |
下列有关反应限度的叙述正确的是
| A.大多数化学反应在一定条件下都有一定的限度 |
| B.当可逆反应达到反应限度时,反应会自动停止 |
| C.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 |
| D.FeCl3与KSCN反应达到平衡时,向其中加少量KCl固体,则溶液颜色变深 |
现有乙酸和两种链状单烯烃的混合物,若其中氧的质量分数为a,则碳的质量分数是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|