甲醇合成反应为:CO(g)+2H2(g)  CH3OH(g)。工业上用天然气为原料,分为两阶段:
CH3OH(g)。工业上用天然气为原料,分为两阶段:
Ⅰ、制备合成气:
用天然气和水制取原料气的方程式为: 。
原料气中常添加CO2以解决合成气中H2过量CO不足问题,请用方程式解释原因 。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________。
Ⅱ、合成甲醇:
(1)反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式____。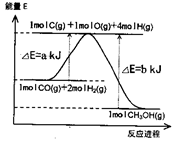
实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
| |
10min |
20min |
30min |
40min |
50min |
60min |
| 3000C |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 5000C |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
(2)在3000C反应开始10分钟内,H2的平均反应速率_____________。
(3)5000C平衡常数K=___________。
(4)在另一体积不变的容器中,充入1.2molCO和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率为 。
判断下列分子间能否形成氢键。
①HClO4 ②H2SO4 ③H3 PO4 ④HNO3 ⑤H2Se ⑥H3PO2 ⑦C2H5OH ⑧CH3 COOH ⑨H2 O2 ⑩HBrO3 ⑪NaOH
Ⅰ、某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)写出反应的化学方程式 。
(2)根据上述反应可推知______________。
a.氧化性:KBrO3>H3AsO4b.氧化性:H3AsO4>KBrO3
c.还原性:ASH3>X d.还原性:X>ASH3
Ⅱ、2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
据此判断:
①该反应的△H 0(填“>”、“<”)。
②在T2温度下,0~2s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是 (填代号) 。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。例如:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)  N2O4(g) ΔH2=-56.9 kJ/mol
N2O4(g) ΔH2=-56.9 kJ/mol
写出CH4 (g)催化还原N2O4(g)生成N2 (g)和H2O (g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为 。
向300mL 1.0mol/L的NaOH溶液中通入标准状况下4.48LCO2气体,充分反应后,所得溶液中:
(1)离子浓度大小关系:
(2)电荷守恒:
(3)物料守恒:
(4)质子守恒:
怎样用化学方法除去下列物质中混有的少量杂质,写出除杂需加入的试剂以及发生反应的离子方程式。
| 需加入的除杂试剂 |
发生反应的离子方程式 |
|
| ①CO2气体中混有HCl杂质 |
|
|
| ②NaHCO3溶液中混有Na2CO3 |
|
|
| ③FeCl2溶液中混有FeCl3杂质 |
|
|
| ④Fe2O3固体中混有Al2O3杂质 |
|
学法题:归纳总结除杂试剂选择的方法
有A、B、C三种烃,分子式都是C5H10,经在一定条件下与足量H2反应,结果得到相同的生成物,写出这三种烃可能的结构简式并命名。