A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量不变,完全燃烧后所产生的CO2的质量就不变。
(1)试写出两组符合上述情况的烃的结构简式:
________________和________________;
________________和________________。(与第一组的物质类别不同)
(2)A、B应满足的条件是_____________________________________________。
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验
证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生
反应的化学方程式是。B处冰水冷却的U型管中有红棕色气
体生成且越接近U型管底部颜色越浅,请解释原因。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中
若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制
NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是;加入少量NaHCO3的目的是调节pH,使溶液中的
(填“Fe3+”“Fe2+”或“Al3+”)沉淀,该工艺中“搅拌”的作用是。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作,若参与反应的O2有11.2L(标准状况),则相当(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成
Fe2(OH)42+聚合离子.该水解反应的离子方程式为。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检验所得产品中是否含有Fe2+,应使用的试剂为。(填字母)。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,2C(s)+O2(g) =2CO(g)△H= 。

(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H2,一定
条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如右图所示:
①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。
②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3) CO2溶于水生成碳酸。已知下列数据:
| 弱电解质 |
H2CO3 |
NH3.H2O |
| 电离平衡常数( 25℃) |
Ka1=" " 4.30 × 10一7 Ka2=" " 5.61× 10一11 |
Kb = 1.77× 10一5 |
现有常温下1 mol·L-1的( NH4)2CO3溶液,已知:NH4+水解的平衡常数Kh=Kw/Kb,
CO32-第一步水解的平衡常数Kh=Kw/Ka2。
①判断该溶液呈 (填“酸”、“中”、 “碱”)性,写出该溶液中CO32-
发生第一步水解的离子方程式。
②下列粒子之间的关系式,其中正确的是。
A.c(NH4+)>c(HCO3-)> c(CO32-)>(NH4+)
B.c(NH4+)+c(H+)= c(HCO3-)+c(OH-)+ c(CO32-)
C. c(CO32-)+ c(HCO3-)+c(H2CO3)=1mol/L
D. c(NH4+)+ c(NH3.H2O)="2" c(CO32-)+ 2c(HCO3-) +2c(H2CO3)
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特
殊电极材料以CO和O2为原料做成电池。原理如图所示:通入CO的管口是(填“c”或“d”),写出该电极的电极反应式:。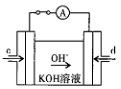
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质
都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更
高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是;
②写出Al2Cl6分子的结构式; ③单分子A1Cl3的立体构型是,缔合双分子Al2Cl6中Al原子的轨道杂化类型是。
③单分子A1Cl3的立体构型是,缔合双分子Al2Cl6中Al原子的轨道杂化类型是。
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原予(如图)
其中有两个原子为10 B,其余为11B,则该结构单元有种不同的结构
类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确
定其晶胞的类型(简单、体心或面心立方);晶胞中距离最近的铝原
子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
有机物G(分子式为 C13H18O2)是一种香料,其合成路线如下图所示。其中A是一种相对分子质量为70的烃,核磁共振氢谱有四个峰且峰面积之比为6:2:1:1;B是一种芳香族含氧衍生物,相对分子质量在100-130之间,B中含氧元素的质量分数为13.1%,F可以使溴的四氯化碳溶液褪色。
已知:

请回答下面的问题:
(1)化合物A的结构简式为____,按系统命名法命名的名称是____。
(2)化合物B的分子式为____,B在上图转化中发生��反应所属的反应类型是____。
(3)写出D→E反应的化学方程式____。
(4)写出C与E生成G反应的化学方程式____。
(5)E的同分异构体有多种,写出符合下列条件的所有物质的结构简式____。
a.属于芳香族化合物且苯环上的一氯代物有两种;b.含有“ ”基团
”基团