下列有关物质的性质和该性质的应用均正确的是
| A.浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体 |
| B.二氧化硫有漂白性,可用于加工食品使食品增白 |
| C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D.铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料 |
实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是
| A.称取5 g左右的干海带——托盘天平 |
| B.灼烧干海带至完全变成灰烬——坩埚 |
| C.过滤煮沸后的海带灰和水的混合物——漏斗 |
| D.用四氯化碳从氧化后的海带灰浸取液中提取碘——长颈漏斗 |
下列分离物质的方法中,根据沸点不同进行分离的是
| A.蒸馏 | B.萃取 | C.重结晶 | D.蒸发 |
可逆反应①X(g)+2Y(g)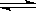 2Z(g)②2M(g)
2Z(g)②2M(g)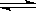 N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。下列判断正确的是:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。下列判断正确的是:
| A.反应①的正反应是吸热反应 |
| B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 |
| C.达平衡(I)时X的转化率为5/11 |
| D.在平衡(I)和平衡(II)中M的体积分数相同 |
室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1;将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)  CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
| A.ΔH2>ΔH3 | B.ΔH1<ΔH3 |
| C.ΔH1+ΔH3=ΔH2 | D.ΔH1+ΔH2>ΔH3 |
将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应NO2(g)+CO(g) CO2(g)+NO(g),并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是
CO2(g)+NO(g),并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是
A.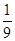 |
B.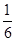 |
C.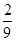 |
D.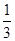 |