常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液中:Na+、Fe2+、NO3-、SO42- |
| B.c(OH一)=10-12的溶液中:NH4+、Al3+、NO3-、Cl- |
| C.由水电离的c(H+)=1×10-13mol·L-1的溶液中:Ba2+、K+、Cl-、[Al(OH)4]- |
| D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
下列说法中正确的是
| A.树状分类法是唯一能表示物质分类的方法 |
| B.等浓度、等体积的磷酸和盐酸,电离出的氢离子数之比为3:1 |
| C.向氢氧化铁胶体中滴加稀硫酸,开始时产生沉淀,继续滴加时沉淀溶解 |
| D.胶体、溶液、浊液分属不同类别的本质是其透过滤纸的性质不同 |
关于分散系,下列叙述中正确的是
| A.直径介于1nm~100nm之间的微粒称为胶体 |
| B.电泳现象可证明胶体带电荷 |
| C.利用丁达尔效应可以区别溶液与胶体 |
| D.按照分散质和分散剂状态不同(固、液、气),它们之间可有6种组合方式 |
下列叙述正确的是
| A.pH相等的盐酸和醋酸溶液中分别加入足量相同的Zn片,反应过程中生成氢气的速率始终相同 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中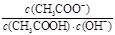 减小 减小 |
| C.醋酸钠溶液中存在反应:CH3COONa+H2O=CH3COOH+NaOH |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 • H2O的电离常数Kb=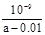 |
25℃时,下列说法正确的是
①pH=2的盐酸和pH=l的盐酸,C(H+)之比为2 :1
②反应2A (s)+B (g)="2C" (g)+D (g)不能自发进行,则该反应△H一定大于0;
③pH=11的氨水稀释到pH=10,稀释后浓度大于原浓度的1/10
④若反应A(g)="2" B (g) 正反应的活化能为Ea kJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
| A.①② | B.②④ | C.③④ | D.①③ |
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。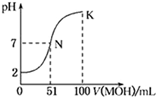
下列说法中正确的是
| A.HA为一元强酸,MOH为一元强碱 |
| B.N点水的电离程度小于K点水的电离程度 |
| C.K点所示溶液中c(A-)>c(M+) |
| D.K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |