如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
下列说法正确的是
| A.分子式C7H16的烃,分子中有4个甲基的同分异构体有4种(不考虑立体异构) |
B. 的名称为:2,2,4﹣三甲基﹣4﹣戊烯 的名称为:2,2,4﹣三甲基﹣4﹣戊烯 |
C.化合物 是苯的同系物 是苯的同系物 |
| D.植物油的主要成分是不饱和高级脂肪酸 |
下列说法不正确的是
| A.可通过酸性高锰酸钾溶液来区别乙烷和乙炔 |
| B.乙烯是石油裂解后的产物 |
| C.石油的分馏、煤的干馏是物理变化,石油的裂解和裂化是化学变化 |
| D.棉花、蛋白质、淀粉都是高分子化合物,都能发生水解反应 |
下列有关说法正确的是( )
| A.根据是否有丁达尔效应,可将分散系分为溶液、胶体和浊液 |
| B.含有最高价元素的化合物一定具有强氧化性 |
| C.NH3、SO2、SO3都是非电解质,氯化钠溶液、硫酸铜溶液都是电解质 |
| D.Na2CO3、NaHCO3、SiO2的俗称分别为纯碱、小苏打、硅石 |
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g•cm-3,溶质的质量分数为ω,溶质的物质的量浓度为Cmol/L.下列叙述中正确的是( )
A.ω=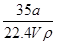 ×100% ×100% |
B.c= |
C.可用装置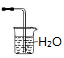 吸收氨气 吸收氨气 |
| D.上述溶液中再加入VmL水 ,所得溶液的质量分数大于0.5ω |
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下的实验:
已知:3NO3-+ 8Al + 5OH- + 2H2O 3NH3 + 8AlO2-,根据以上的实验操作与现象,该同学得出的结论正确的是( )
3NH3 + 8AlO2-,根据以上的实验操作与现象,该同学得出的结论正确的是( )
| A.沉淀2为氢氧化铝 |
| B.Cl-一定存在,且n(Cl‑)≥0.05mol |
| C.该试样溶液中一定存在的离子有NH4+、Mg2+、Al3+、SO42-和NO3- |
| D.试样中可能存在Na+、Cl-、Al3+ |